Čím vyšší je teplota, tím vyšší je rychlost reakce.
To lze snadno vidět v mnoha situacích v našem každodenním životě, jako v následujících příkladech:
- Když chceme zpomalit rozkladnou reakci jídla, snížíme teplotu a umístíme ji do chladničky;

- Pokud chceme urychlit varnou reakci jídla, vložte ji do hrnce na vaření. tlak, který se zvyšujícím se tlakem také zvyšuje teplotu varu kapalné vody, ve které jídlo je;

- Požáry jsou obecně obvykle zničující, protože se zvyšuje teplota prostředí, což způsobuje zvýšení rychlosti spalovací reakce;
- Zpomalit metabolické chemické procesy, snížit pravděpodobnost poškození mozku v důsledku nedostatek kyslíku, některé operace se provádějí snížením tělesné teploty pacienta a dosahem kolem 15 ° C;
- Pokud vložíme šumivou tabletu do sklenice horké vody a další do sklenice studené vody, první se rozpustí mnohem rychleji.
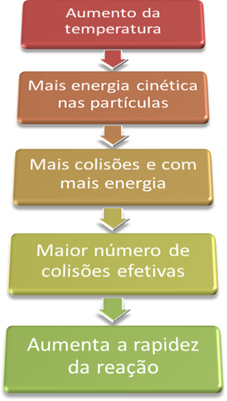
Co ale vysvětluje přímo úměrný vliv teploty na reakční rychlost?
Je to proto, že jak je vysvětleno v textu „Podmínky pro výskyt chemických reakcí„, Aby reakce mohla pokračovat, je nutné splnit určité podmínky, jako jsou částice musí se srážet efektivně as minimální potřebnou energií, která se nazývá aktivační energie.
Když tedy zvýšíme teplotu systému, zvýšíme také míchání reagujících částic a poskytneme jim více kinetické energie. S tímto dojde k více kolizím a více energie, což zvýší množství částic, které budou reagovat, a následně zvýší rychlost reakce.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm
