Na oxidační reakce se sekundárními alkoholy jsou ty, ve kterých dochází k interakci mezi organickou sloučeninou ze skupiny alkoholy, které musí být sekundární, a takzvané Bayerovo činidlo (KMnO4) v kyselém prostředí.
Kdykoli je Bayerovo činidlo v kyselém médiu (aq/H+), prochází rozkladnou reakcí, přičemž vzniká oxid draselný, oxid manganitý II a vznikající kyslíky, jak můžeme vidět v následující rovnici:
2 kmnO4 (vod./H+) → 2 MnO + K2O + 5 [O]
Při jakékoli oxidační reakci je vznikající kyslíkyvzniklý rozkladem manganistanu draselného v kyselém prostředí, napadají uhlíkové řetězce které mají pí vazby mezi uhlíky (alkeny, alkyny a alkadieny) nebo které jsou uzavřené (cyklany, aromatické cykleny), vytvářející nové chemické sloučeniny.
V případě oxidační reakce v sekundárních alkoholech, před pochopením reakčního mechanismu je nutné si zapamatovat pojem sekundární alkohol. je nazýván sekundární alkohol ten, ve kterém je hydroxyl (OH) připojen k a sekundární uhlík (uhlík vázaný přímo na dva další atomy uhlíku). Viz zastoupení sekundárního alkoholu:
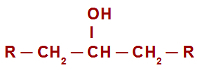
Obecný strukturní vzorec sekundárního alkoholu
Při každé oxidační reakci v alkoholech nascentní kyslíky napadají vodíky umístěné na uhlíku, který má hydroxylovou skupinu. V případě oxidačních reakcí v sekundárních alkoholech mají kyslíky v každé struktuře tohoto typu alkoholu k útoku pouze jeden atom vodíku.
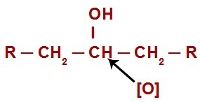
Vznikající kyslík napadající sekundární alkohol
Při útoku na vodík (H) přítomný v hydroxylovém uhlíku (OH) tvoří vznikající kyslík ([O]) nový hydroxyl na stejném uhlíku. Takže máme gemino diol ve vězení. Jelikož je geminodiol (HO – C – OH) nestabilní, rozkládá se na molekulu vody.Mezi uhlíkem a kyslíkem, který zbývá z jednoho z hydroxylů, však dochází k tvorbě dvojné vazby (pí a sigma).
Nepřestávej teď... Po reklamě je toho víc ;)
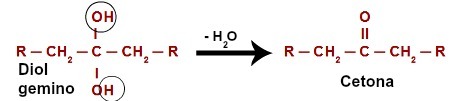
Chemická rovnice oxidace sekundárního alkoholu
Produktem vzniklým oxidační reakcí sekundárních alkoholů je vždy a keton, protože dvojná vazba je vždy generována na sekundárním uhlíku, což má za následek karbonyl mezi dvěma uhlíky, čímž se tvoří keton.
Podívejte se nyní a příklad oxidační reakce v sekundárních alkoholech.
Příklad: Butan-2-ol
Ó butan-2-ol je sekundární alkohol, protože hydroxyl je připojen k sekundárnímu atomu uhlíku. Takže na uhlíku, který má hydroxyl, je pouze jeden vodík. Tuto skutečnost si můžeme ověřit ve struktuře níže:

Při vystavení médiu obsahujícímu vodu, kyselinu a KMnO4 (Bayerovo činidlo), váš vodík je napaden vznikajícím kyslíkem, transformující se na nový hydroxyl, jehož výsledkem je gemino diol.

Nakonec dochází k rozkladu dvou hydroxylů přítomných v geminodiolu, což vede k molekule vody a ketonu, kvůli potřebě vytvořit vazbu mezi uhlíkem a jedním z kyslíků rozložených hydroxylů.

můžeme reprezentovat celou oxidační reakci butan-2-olu podle následující rovnice:

Ode mě, Diogo Lopes Dias
Chtěli byste odkazovat na tento text ve školní nebo akademické práci? Koukni se:
DNY, Diogo Lopes. "Oxidační reakce v sekundárních alkoholech"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/reacoes-oxidacao-alcoois-secundarios.htm. Zpřístupněno 27. července 2021.
Chemie

Hydroxylová funkční skupina, Primární alkoholy, Sekundární alkoholy, Terciární alkoholy, Methanol, Glycerol, Ethanol, příprava nitroglycerinu, výroba barev, výroba alkoholických nápojů, kyselina octová, palivo automobilů.