THE Chemická kinetika je obor, který studuje faktory, které ovlivňují rychlost vývoje chemických reakcí, tj. rychlost, při které k nim dochází. V této oblasti probíhá stále více výzkumů, protože často chceme některé reakce urychlit nebo jiné zpomalit. To je zvláště důležité pro průmyslová odvětví a tento výzkum má významné technologické důsledky.
Ale protože rychlost reakce se může lišit v každém časovém intervalu a od jedné látky k druhé, je obvyklé vypočítat průměrná rychlost reakce.
Zvažte následující obecnou reakci, kde jsou koeficienty malými písmeny a reaktanty a produkty jsou reprezentovány velkými písmeny:
a A + b B → c C + d D
Bude uvedena průměrná rychlost této reakce dělením průměrné rychlosti reakce kterékoli z reagujících látek nebo průměrné rychlosti tvorby kteréhokoli z produktů příslušným koeficientem v chemické rovnici. To je dáno:
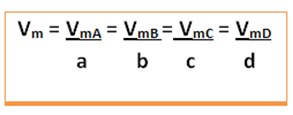
Zvažte například reakci rozkladu peroxidu vodíku:
2 hodiny2Ó2 (aq) → 2 H2Ó(1) + 1 O.2 (g)
Řekněme, že za 1 minutu bylo vytvořeno 0,3 mol / l H2O a 0,15 mol / l O
2, zatímco 0,3 mol / l H se rozložilo2Ó2, tj. průměrné rychlosti rozkladu a tvorby těchto látek v reakci jsou:PROTImH2O2 = 0,3 mol / l. min
PROTImH2O = 0,3 mol / l. min
PROTImO2 = 0,15 mol / l. min
Průměrná rychlost globální reakce se zjistí tak, že se vezme jedna z těchto hodnot a vydělí se příslušným koeficientem v rovnici:
PROTIm = PROTImH2O2 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
PROTIm = PROTImH2O = 0,3 mol / l. min = 0,15 mol / l. min
2 2
PROTIm = PROTImO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Všimněte si, že tři hodnoty jsou stejné, proto je reakční rychlost stejná jako funkce jakéhokoli reaktantu nebo produktu ve stejném časovém intervalu.
Jak však byly zjištěny hodnoty průměrných rychlostí každé z látek zapojených do těchto reakcí?
Dá se to spočítat dělením změny v koncentraci látky (činidla nebo produktu) časovým intervalem. Pokud se chystáme určit průměrnou rychlost jednoho z činidla reakce, budeme muset dát a záporné znaménko dříve, nebo jinak zvažte hodnotu koncentrace v modulu ||, protože protože koncentrace reaktantu v průběhu času klesá, hodnota rychlosti by byla záporná, ale neexistuje žádná záporná rychlost.
Nepřestávejte... Po reklamě je toho víc;)

Zvažte například následující reakci rozkladu ozónového plynu (O3 (g)) v plynném kyslíku (O2 (g)):
2 O.3 (g) → 3 O.2 (g)
Řekněme, že v balónu bylo 10 molů ozonového plynu, ale po 1 minutě zůstaly jen 4 moly; to znamená, že 6 molů ozonu se změnilo na plynný kyslík. Takže máme:
2 O.3 (g) → 3 O.2 (g)
t = 0 min 2 mol / L 0 mol / L
vytvořené výdaje
6 mol / L 9 mol / L
t = 1 min 4 mol / L 9 mol / L
Všimněte si, že protože reakční poměr je 2: 3, pak pokud bylo použito 6 molů O3Bylo vytvořeno 9 mol O2. Takže po 1 minutě máme následující průměrné rychlosti:
PROTIm = - The [The3]
t
PROTIm = - ([O.3final - Ó3 počáteční])
tFinále - tpočáteční
PROTIm = - ([4 - 10])
1– 0
PROTIm = 6 mol / l. min→ Po dobu 1 minuty reagovalo v každém litru systému 6 mol ozonu.
PROTIm = The [The2]
t
PROTIm = ([Ó2final - Ó2 počáteční])
tFinále - tpočáteční
PROTIm = ([9 - 0])
1– 0
PROTIm = 9 mol / l. min→ Během 1 minuty se v každém litru systému vytvořilo 9 molů kyslíku.
To nám ukazuje, že můžeme vypočítat průměrnou rychlost jako funkci reaktantů nebo jako funkci produktů.
Nyní, pokud chceme vypočítat průměrnou rychlost této globální reakce, udělejte to, co jsme ukázali na začátku: vydělte každou z těchto rychlostí jejich příslušnými koeficienty v chemické rovnici:
PROTIm = PROTImO3 = 6 mol / l. min = 3 mol / l. min
2 21
PROTIm = PROTImO2 = 9 mol / l. min = 3 mol / l. min
3 3
PROTIm = PROTImO3 = PROTImO2
23
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Rychlost chemických reakcí“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Zpřístupněno 27. června 2021.