Na kovalentní vazby, také zvaný molekulární nebo homopolární vazby, jsou ty, které se vyskytují mezi atomy elektronegativní prvky, tj., s tendencí přijímat elektrony, navazovat vazbu sdílení elektronů z jejich valenčních skořápek.
Kovalentní vazba může nastat mezi následujícími prvky: vodík, nekovy a polokovy. Kovy se nikdy neúčastní tohoto typu spojování.
Uvažujme jednoduchý příklad kovalentní vazby: vazba tvořící vodíkový plyn (H2):
H + H → H2
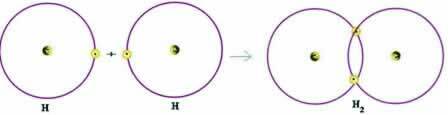
Všimněte si, že oba atomy potřebovaly přijmout elektron, aby dokončily svou valenční skořápku - podle oktetového pravidla - a tímto způsobem zůstaly stabilní. Proto sdíleli své elektrony a tímto způsobem oba měli dva elektrony, měli kompletní K-plášť a získali konfiguraci hélia ušlechtilého plynu.
Toto sdílení elektronů odlišuje tento typ vazby od iontové vazby, při které dochází k přenosu elektronů.
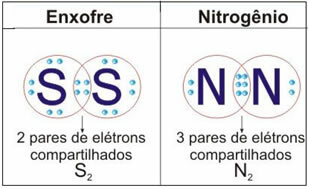
Na obrázku níže jsou uvedeny další dva příklady tohoto případu:
Nepřestávejte... Po reklamě je toho víc;)
V tomto typu vazby dochází k tvorbě molekul, které mohou být reprezentovány jejich příslušnými
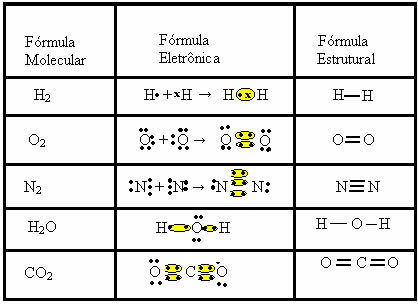
molekulární vzorce, tj. nejjednodušší reprezentace, která udává, kolik atomů každého prvku je v molekule. Některé příklady molekulárních vzorců jsou: H2, S.2, O2, Ne2, H2O, CO2, atd.Kovalentní vazbu lze představovat dvěma dalšími vzorci:
- Elektronická formule nebo Lewisova formule: v tomto vzorci se také objevují elektrony valenčního pláště každého atomu a tvorba elektronických párů. Tyto elektrony jsou symbolizovány znaménky . nebo x;
- Plochý strukturní vzorec nebo Couper strukturní vzorec: zobrazuje odkazy prvků, přičemž každý sdílený pár odpovídá pomlčce. Pokud je to jen pomlčka, říkáme tomu jediný odkaz; pokud existují dva, dvojná vazba; a pokud existují tři pomlčky, trojná vazba.
Podívejte se na další příklady kovalentních vazeb, které představují tyto tři chemické vzorce:
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Kovalentní vazby"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. Zpřístupněno 27. června 2021.