Na spalovací reakce jsou přítomny v mnoha aspektech našeho každodenního života. Například hlavní zdroje výroby energie pocházejí ze spalování nebo spalování určitých paliv, jako je mimo jiné etanol, benzín, dřevěné uhlí. Navíc energie, kterou potřebujeme k přežití a práci, je výsledkem spalovacích reakcí, které probíhají uvnitř našich buněk, když „spálíme“ jídlo, které jíme.
Ale co je potřeba ke spalovací reakci?
Jsou potřeba tři věci:
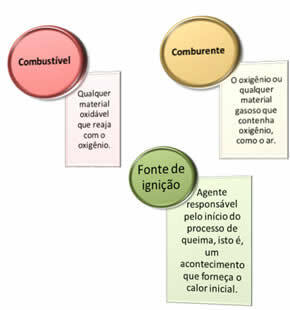
Tyto tři faktory tvoří požární trojúhelníkprotože jakmile začne spalovací reakce, uvolněná energie udržuje reakci a umožňuje jí pokračovat, dokud palivo, okysličovadlo nebo teplo (uvolněná energie) nezmizí. To znamená, že tam bude a Řetězová reakce.
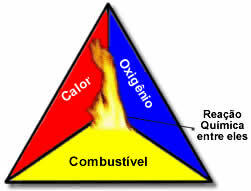
Pokud například někdo hodí zapálenou cigaretu do lesa, dojde k požáru (spalovací reakce). V tomto případě Keř to je pohonné hmoty, O kyslík přítomný ve vzduchu atmosférický je okysličovadlo to je cigareta rozsvíceno bylo zdroj vznícení. Toto spalování bude pokračovat, dokud nebude odstraněn jeden ze tří faktorů. Pokud hasiči házejí vodu, horko se odstraní. Ale i když se nic neudělá pro zastavení tohoto hoření, v určitém okamžiku skončí, tedy až dojde palivo (les).
Jak již bylo zmíněno, při těchto reakcích se uvolňuje teplo, spalování je tedy exotermická reakce. Tento typ reakce je však nedokonalým spalováním. Abyste pochopili proč, podívejte se na rozdíl mezi úplným a nedokonalým spalováním:
Kompletní spalování:
Při analýze organických sloučenin jako paliv musíme:
| THE úplné spalování nastane, když je uhlíkový řetězec přerušen a všechny uhlíkové atomy v uhlíkovém řetězci jsou zcela oxidovány. |
| Vy tvarované produkty uhlovodíky bude CO2 (oxid uhličitý) a H2Ó (Voda). |
Pozorujte úplné spálení isooktanu, který je jednou ze složek benzínu.
C8H18(g) +25/2 O2 (g) → 8 CO2(g) + 9 hodin2Ó(1)
nedokonalé spalování
| V tomto případě není dostatek okysličovadla, tedy dostatek kyslíku ke spálení veškerého paliva. |
| Takto vzniklé produkty jsou CO (oxid uhelnatý) a H2Ó. |
Pozorujte stejné spalování isoktanu, nyní však neúplně:
C8H18(g) + 17/2 O2(G) → 8 CO (G) + 9 hodin2Ó(1)
Vypalování lesů je příkladem, protože výsledné emise se skládají z CO a konkrétních látek, jako jsou saze (C), stejně jako popel a další jednoduché a složité organické sloučeniny. Oxid dusíku, ozón a aldehydy mohou vznikat také jako výsledek sekundárních reakcí v důsledku přítomnosti dalších složek ve vzduchu.
C8H18(g) + 9/2 O2 (g) → 8C (G) + 9 hodin2Ó(1)
Autor: Jennifer Fogaça
Vystudoval chemii
Brazilský školní tým
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm
