Z této směsi plynů vznikají homogenní směsi nebo plynné roztoky. Vzduchem se šíří například plyny, které vycházejí z továrních komínů nebo výfuků automobilů atmosférické a postupem času jsme je již nebyli schopni rozlišit, protože docházelo k difúzi těchto plynů vzduch.

Plyny emitované komíny se rozptýlí a „ztratí“ v atmosférickém vzduchu, protože objem vzduchu je mnohem větší než objem kouře.
| THE difúze plynu je samovolný pohyb plynu druhým, to znamená jeho šíření v jiném plynném prostředí. |
| THE výpotek plynů je zvláštní typ difúze, při které dochází k úniku plynů malými otvory (nebo porézními stěnami, což je soubor malých otvorů). |
Například balonky prodávané dětem jsou plněné heliem. Postupem času tento plyn končí průchodem gumovými póry balónku, to znamená, že dochází k jeho výronu. To se projevuje tím, že se balónek po několika hodinách vyfoukne.
Skotský chemik Thomas Graham v roce 1829 studoval toto chování plynů. Došel k závěru, že rychlost, kterou plyn difunduje nebo vytéká do jiného, souvisí s jeho hustotou. Když se jeho experimentální údaje opakovaly pro všechny plyny, vytvořil následující zákon, který nese jeho jméno:
Grahamův zákon: rychlost difúze nebo výronu plynu je nepřímo úměrná druhé odmocnině jeho hustoty.
Matematicky lze tento zákon vyjádřit rovnicí:
v α 
Nebo, když srovnáme dva různé plyny, máme:
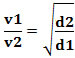
Jednotka použitá v tomto případě je „objem, který unikne za jednotku času“; tedy obecně L/min (litry za minutu).
Plyny s nižší hustotou tedy difundují rychleji. Pokud je ve stejných teplotních a tlakových podmínkách, můžete to také spojit s hmotou molární plyn: čím větší je hustota plynu, tím větší je jeho molární hmotnost a tím nižší je jeho rychlost difúze; a naopak. Máme tedy:
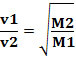
Autor: Jennifer Fogaça
Vystudoval chemii
Brazilský školní tým
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm
