Osmóza je pohyb vody, který probíhá uvnitř buněk polopropustnou membránou.
V tomto procesu se molekuly vody pohybují z méně koncentrovaného média do koncentrovanějšího média.
Osmóza tedy slouží k vyrovnání obou stran membrány, což způsobí, že médium bohaté na rozpuštěné látky bude zředěno rozpouštědlem, kterým je voda.
Jak dochází k osmóze?
Osmóza je považována za pasivní transport, jako při průchodu membránou není zbytečná energie.
V procesu osmózy má voda, která je rozpouštědlem, tendenci procházet semipermeabilní membránou, aby se vyrovnala koncentrace roztoku. Tato akce se provádí, dokud se osmotický tlak nestabilizuje.
Voda se proto přirozeně pohybuje z méně koncentrované oblasti do koncentrovanější.
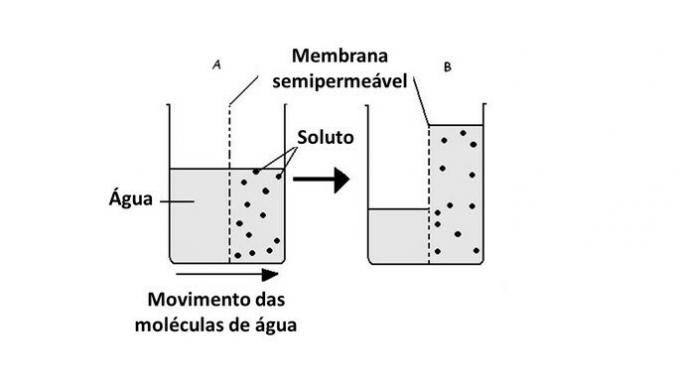
Průchod vody z jednoho média do druhého se provádí v buňkách pomocí transportu proteinů v membráně, aquaporinů. Osmóza tedy nastává vždy, když existuje rozdíl v koncentraci mezi vnějším a vnitřním prostředím buňky.
Výsledek osmózy se používá v procesech výměny živin živočišných a rostlinných buněk.
Přečtěte si také o Pasivní doprava a Aktivní transport.
Hypotonické, izotonické a hypertonické řešení
Jak jsme viděli, cílem procesu osmózy je vyrovnání koncentrací roztoků, dokud nebude dosaženo rovnováhy. K tomu máme následující typy řešení:
- hypertonické řešení: představuje vyšší osmotický tlak a koncentraci solute.
- hypotonické řešení: představuje nižší osmotický tlak a koncentraci solute.
- izotonické řešení: koncentrace rozpuštěné látky a osmotický tlak jsou stejné, čímž se dosáhne rovnováhy.
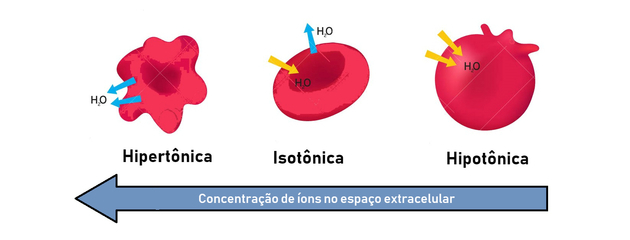
Osmóza tedy probíhá mezi hypertonickým (koncentrovanějším) a hypotonickým (méně koncentrovaným) způsobem vytváření rovnováhy.
příklady osmózy
V buňkách je plazmatická membrána obálkou tvořenou lipidovou dvojvrstvou, která brání pohybu vody v buňce. Existují však proteiny specializované na jeho strukturu, aquaporiny, které působí jako kanály, které usnadňují průchod molekul vody.
V hypertonickém prostředí mají buňky tendenci se zmenšovat, protože ztrácejí vodu. Buňka umístěná v hypotonickém médiu může bobtnat, dokud se nerozbije, protože dochází k pohybu vody do buňky.
Podívejte se níže, jak se osmóza vyskytuje v živočišných a rostlinných buňkách.
Osmóza v živočišné buňce
když zvířecí buňka, stejně jako červené krvinky, jsou vystaveny médiím s různými koncentracemi, k pohybu vody v buňce dochází následovně:
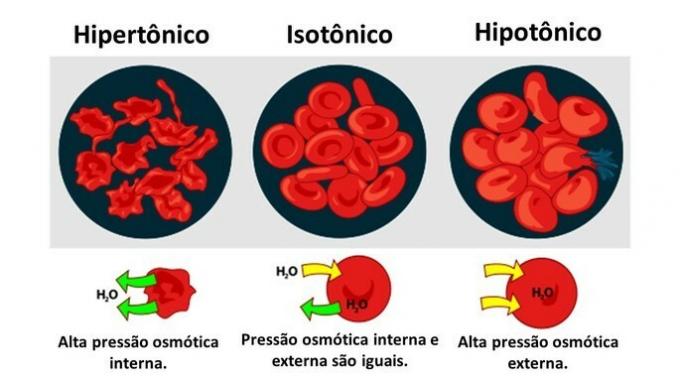
Když je médium bohaté na solut, což je roztok, který je hypertonický vzhledem k cytoplazmě, buňky ztrácejí médiu vodu a chřadnou.
Když je médium chudé na rozpuštěnou látku, hypotonický roztok, molekuly vody mají tendenci pronikat do buňky, a přestože je membrána rezistentní, v závislosti na množství může dojít k narušení.
Osmóza rostlinných buněk
Pohyb vody v rostlinných buňkách probíhá mezi buněčnou vakuolou a extracelulárním prostředím.
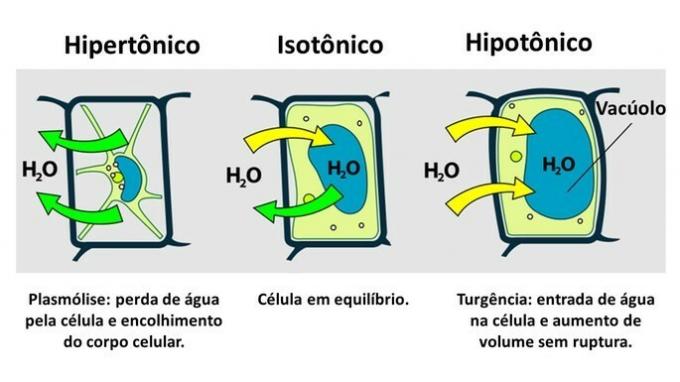
THE rostlinná buňka kromě plazmatické membrány má velmi odolnou buněčnou stěnu, kterou tvoří celulóza.
Na rozdíl od živočišné buňky proto rostlinná buňka odolává narušení, když je vložena do hypotonického prostředí, kde má voda tendenci pronikat do buňky. Buňka bobtná a zvětšuje svůj objem, ale buněčná stěna zabraňuje prasknutí.
Ztráta vody rostlinnou buňkou, která je vložena do hypertonického prostředí, se nazývá plazmolýza. Vstup vody do vakuoly, když je buňka v hypotonickém médiu, se nazývá turgency, kdy dochází ke zvýšení objemu buňky.
Jak osmotický tlak ovlivňuje osmózu?
Rozpuštěnou látkou je jakákoli látka, kterou lze zředit v rozpouštědle, například cukr rozpuštěný ve vodě. Zatímco osmotický tlak je tlak vyvíjený na pohyb vody.
Protože osmóza je proces, který probíhá od nejméně koncentrovaného (hypotonického) po nejkoncentrovanější (hypertonické) médium v hledat rovnováhu, osmotický tlak je tlak vyvíjený na systém, aby se zabránilo vzniku osmózy přirozeně.
Proto čím větší je rozdíl koncentrací mezi hypertonickým a hypotonickým médiem, tím větší by měl být osmotický tlak aplikovaný na koncentrovanější roztok, aby se zabránilo osmóze.
Dozvědět se víc o osmotický tlak.
Co je reverzní osmóza a jak funguje
Reverzní osmóza je průchod vody v opačném směru k osmóze. Voda tedy přechází z koncentrovanějšího roztoku do méně koncentrovaného.
Reverzní osmóza probíhá působením tlaku většího než přirozený osmotický tlak.
Protože semipermeabilní membrána umožňuje pouze průchod rozpouštědla (čisté vody), zadržuje rozpuštěné látky.
Příkladem reverzní osmózy je přeměna slané vody na čerstvou vodu odsolovacím procesem.
Dozvědět se víc o reverzní osmóza.
Rozdíl mezi osmózou a difúzí
Difúze je průchod velmi malých molekul plynů a rozpuštěných látek rozpuštěných ve vodě skrz plazmatická membrána. V tomto případě se molekuly rozpuštěné látky přesunou z koncentrovanějšího média do méně koncentrovaného média. Pohybují se podél koncentračního gradientu a rozprostírají se po dostupném prostoru.
THE usnadněná difúze jedná se o průchod látkami, které se nerozpouštějí v lipidech, pomocí membrán, pomocí proteinů, které prostupují lipidovou dvojvrstvou.
Stejně jako osmóza je i difúze považována za pasivní doprava, protože se vyskytuje ve prospěch koncentračního gradientu.
Zvědavost
Výraz „učení pomocí osmózy“ je široce používán studenty, kteří by se chtěli naučit nový obsah, aniž by museli studovat, to znamená bez vynaložení úsilí.
Přečtěte si také:
- Rozpuštěná látka a rozpouštědlo
- Sodná a draselná pumpa
- Selektivní propustnost


