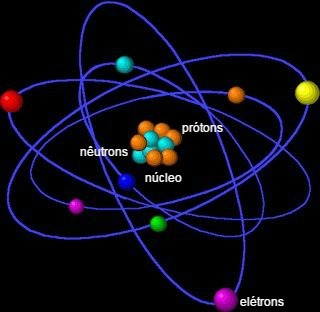
Atom je základní jednotka hmoty a nejmenší zlomek schopný identifikovat chemický prvek, protože si zachovává svoji identitu. Termín atom je odvozen z řečtiny a znamená nedělitelný.
Skládá se z jádra, které obsahuje neutrony a protony, a elektronů, které obklopují jádro.
atomová struktura
Atom je tvořen malými částicemi, nazývanými také subatomární částices: elektrony, protony a neutrony.
Většina hmoty atomu je koncentrována v jádru, malé, husté oblasti. Jeho největší objem se nachází v elektrosféře, místě prázdných prostor, protože elektrony obíhají kolem jádra.
elektrony
Ó elektron má záporný elektrický náboj (-1) a téměř žádnou hmotnost, protože jeho hodnota je 9,11 x 10-28 g e je asi 1840krát menší než hmota jádra. Jsou to drobné částice, které se velmi rychle otáčejí kolem atomového jádra.
Elektrony, které se nacházejí v nejvzdálenějších oblastech atomu, jsou odpovědné za tvorbu chemických vazeb, ke kterým dochází darováním, příjmem nebo sdílením elektronů.
protony
Ó proton má kladný elektrický náboj (+1) stejné absolutní hodnoty jako náboj na elektronech. Tímto způsobem mají proton a elektron tendenci se navzájem elektricky přitahovat.
Prostřednictvím protonů je možné rozlišit chemické prvky, protože každý atom prvku má ve svém jádře definovaný počet protonů, který se nazývá protonové číslo.
neutrony
Ó neutron nemá vůbec žádný náboj, to znamená, že je elektricky neutrální. Spolu s protony tvoří atomové jádro, které nese celou hmotnost atomu (99,9%). Proton i neutron mají hmotnost přibližně 1,67 x 10-24 G. Tato hodnota představuje jednotku atomové hmotnosti 1 μ.
Neutron poskytuje atomovému jádru stabilitu, protože jaderná síla způsobuje jeho přitahování k elektronům a protonům.
Pouze atom vodíku nemá neutrony, je tvořen pouze elektronem otáčejícím se kolem protonu.
V následující tabulce najdete a abstraktní s informacemi o subatomárních částicích.
| Částice | Symbol |
Těstoviny (v jednotce atomová hmotnost) |
Nabít (v jednotce elektrický náboj - u.c.e) |
Umístění |
|---|---|---|---|---|
| Proton | +1 | jádro | ||
| Neutron | 0 | jádro | ||
| Elektron | -1 | elektrosféra |
Atom ve svém základním stavu je elektricky neutrální, protože počet protonů se rovná počtu elektronů a opačné náboje, kladné a záporné, se navzájem ruší.
Například sodík (Na) má atomové číslo 11, to znamená, že jeho jádro má 11 protonů. V důsledku toho je v elektrosféře atomu tohoto prvku 11 elektronů.
Přečtěte si více o atomová struktura.
atomové složení
Jak jsme viděli, atom je tvořen malou a hustou střední oblastí zvanou jádro a kolem ní je a elektrosféra, kde se nacházejí elektrony, které lze rozdělit na elektronické vrstvy, energetické úrovně a atomové orbitaly.
elektronické vrstvy
atom představuje energetické hladiny, které odpovídají sedmi vrstvám kolem jádra a jsou v nich elektrony, které kolem něj obíhají. Vrstvy se nazývají K, L, M, N, O, P a Q.
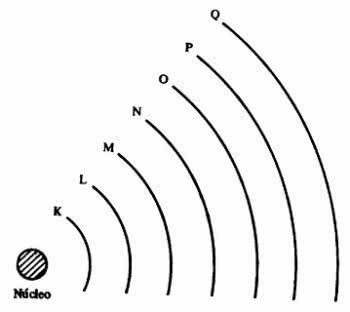
Každá skořápka může obsahovat určitý počet elektronů, jak je uvedeno v tabulce níže.
| Úroveň energie | elektronická vrstva | Maximální počet elektronů |
|---|---|---|
| 1º | K. | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | Ó | 32 |
| 6º | P | 18 |
| 7º | Q | 8 |
Například atom helia (He) má atomové číslo 2, a proto má v jádru 2 protony. V důsledku toho jsou v elektrosféře atomu pouze 2 elektrony, které jsou umístěny v prvním a jediném elektronovém plášti atomu, v plášti K, který odpovídá první energetické úrovni.
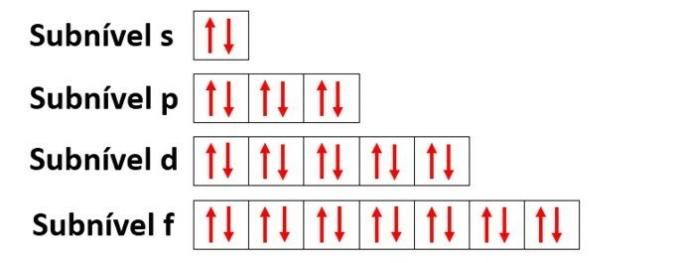
Energetické podúrovně
Úrovně energie obsahují podúrovně, které jsou reprezentovány s, p, d, f. Každá podúroveň pojme maximální počet elektronů, které jsou 2, 6, 10 a 14.

S touto informací je možné elektronická distribuce atomu a znát umístění nejvzdálenějšího a nejenergetičtějšího elektronu.
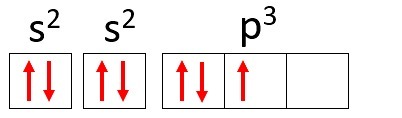
Příklad: Dusík (N)
Atomové číslo: 7
Elektronická distribuce: 1 s2 2 s2 2 s3
Atom dusíku má dvě energetické hladiny, K a L, a jeho 7 elektronů zaujímá podúrovně s a p.
K: s2 = 2 elektrony
L: s2 + str3 = 5 elektronů
Všimněte si, že L plášť může obsahovat až 8 elektronů, ale v atomu dusíku je v něm jen 5 elektronů.
atomové orbitaly
Orbitaly charakterizují oblast, která s největší pravděpodobností najde elektron v energetické podúrovni (s, p, d, f) v elektronickém obalu (K, L, M, N, O, P, Q).
- s podúroveň: má 1 oběžnou dráhu, která pojme až 2 elektrony
- p úroveň: má 3 orbitaly, které obsahují až 6 elektronů
- Podúroveň d: má 5 orbitalů, které obsahují až 10 elektronů
- Podúroveň f: má 7 orbitalů, které obsahují až 14 elektronů
Jako příklad bychom mohli znovu použít dusík a distribuovat jeho 7 elektronů na atomové orbitaly:
Typy atomů
Při pozorování počtu protonů, neutronů a elektronů můžeme atomy srovnávat a klasifikovat do nich izotopy, isobary a izotonů.
Chemický prvek lze definovat jako skupinu atomů se stejným počtem protonů. Tyto atomy se nazývají izotopy, protože mají stejné atomové číslo a různé hmotnosti.
Například v přírodě existují 3 izotopy prvku vodík (H): protium , deuterium
a tritium
.
Atomy různých chemických prvků lze klasifikovat jako izotony, pokud mají různá atomová čísla a hmotnosti, ale stejný počet neutronů.
Isobary jsou atomy různých prvků, to znamená, že mají jiné atomové číslo, ale stejné hmotnostní číslo.
Přečtěte si více o izotopy, izobary a izotony.
Atomové modely (atomové modely)
Řecký filozof Aristoteles (384 a. C. - 322 a. C) pokusil se vysvětlit složení všech látek z prvků země, vzduchu, ohně a vody.
Democritus (546 a. C - 460 a. C), řecký vědec a matematik, formuloval myšlenku, že existuje limit pro maličkost částic. Řekl, že se stanou tak malými, že je již nebude možné rozdělit. Tuto částici nazval „atomem“.
Po většinu 19. století to byl Atomový model Dalton, Anglický vědec, který navrhl atomovou teorii, která šla daleko za myšlenky starověku.
Tato teorie říká, že všechny látky jsou tvořeny malými nedělitelnými částicemi zvanými atomy, které by byly jako kulečníkové koule. Jak postupovaly studie o struktuře hmoty, bylo zjištěno, že atom je tvořen dalšími malými částicemi zvanými subatomární.
S objevem elektronu thomson formuloval model známý jako hromadný pudink, který popsal atom jako pozitivní kouli se záporně nabitými elektrony zapuštěnými do jejího povrchu.
Pomocí experimentů fyzik Rutherford zjistil, že atom měl dutiny a elektrony kolem extrémně malého pozitivního jádra. Rutherford tedy navrhl jaderný model představující atom.
Bohr vylepšil model navrhovaný Rutherfordem zjištěním, že elektrony se neotáčejí kolem jádra náhodně, ale na konkrétních drahách. Tento model se stal známým jako planetárium.
Přečtěte si také o:
- Atomové modely
- Thomsonův atomový model
- Bohrův atomový model
- Rutherfordův atomový model
- Vývoj atomových modelů



