Organokovový jsou organické sloučeniny, které mají alespoň jeden atom kovu navázaný na atom uhlíku. Kovy, které tvoří tento typ látky, jsou obvykle: hořčík (Mg), zinek (Zn), olovo (Pb) a rtuť (Hg).
Mezi nejběžnější organokovové látky patří organomagnesium, známější jako Grignardovy sloučeniny nebo činidla, jehož kovem vázaným na uhlík je hořčík, a ten je zase vázán na halogen, kterým může být jeden z následujících prvků rodiny 17 periodické tabulky: fluor (F), chlor (Cl), brom (Br) a jod (I).
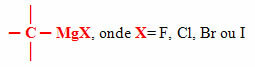
Organokovové sloučeniny jsou obvykle toxické, protože obsahují kovy, které se hromadí v těle a jsou rozpustnější v organických sloučeninách než jiné anorganické sloučeniny, které je obsahují kovy. Příkladem toho je, když horníci nebo průmyslová odvětví vrhají organokovové sloučeniny do jezer a řek. Výsledkem jsou závažné problémy pro zdraví uživatelů těchto vod (lidí i zvířat) i další ekologické problémy.
Níže uvádíme tři příklady organokovových sloučenin přítomných v našem každodenním životě:
• Ethylchlorid rtuťnatý (H
• Butyl-lithium (H3C CH2 CH2 CH2 ─ Li): tato sloučenina se používá jako iniciátor polymerace pro výrobu elastomerů, tj. Polymerů s elastickými vlastnostmi;
• Tetraethyl-olovo (nebo tetraethyl-olovo): po dlouhou dobu byla tato sloučenina používána jako protikus v benzinu, protože zvyšovala její oktanové číslo a účinnost motoru. Spolu se spalováním benzínu však tato sloučenina uvolňovala olovo do životního prostředí, což způsobilo znečištění ovzduší. Toto olovo je toxické, znečišťuje životní prostředí a je obzvláště nebezpečné, protože ovlivňuje mozek a má vliv na motorickou koordinaci.
Nepřestávejte... Po reklamě je toho víc;)
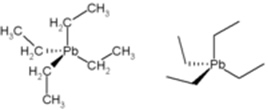
Struktura tetraethyl-olova.
Na jeho místo se tedy používá jiný organokov: ferrocen, který má ve své struktuře dva cyklopentadienylové kruhy na každé straně železa, jak je znázorněno v chemických strukturách níže:
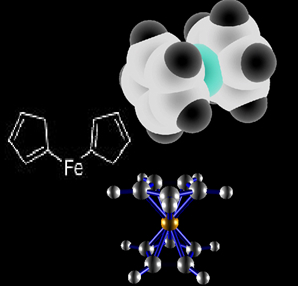
Ferrocenová struktura.
Názvosloví organometaliky se řídí následujícím schématem:

Příklady:
CH3
│
CH2
│
H3C ─ CH2 ─Al: triethylaluminium
│
CH2
│
CH3
H3C ─ CH2 ─ CH2 ─ Li: propyllithium
Pokud se jedná o Grignardovu sloučeninu, máme:

Příklady:
H3C CH2 ─ MgCl: ethylchlorid hořečnatý
H2C ═ CH ─ MgBr: vinylbromid hořečnatý
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Organokovové sloučeniny"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/compostos-organometalicos.htm. Zpřístupněno 27. června 2021.



