Čistá látka je tvořena jediným typem chemických látek, to znamená, že její složení a vlastnosti jsou neměnné. Mix obsahuje více než jeden typ komponenty, takže jeho organizace se liší.
Čistou látku od směsi tedy můžeme odlišit, pouze pokud známe její složení.
Když porovnáme sklenici vody a sklenici rozpuštěného cukru, naše oči nezaznamenají žádný rozdíl. Pokud však spolkneme obsah dvou sklenic, všimneme si, že jedna je čistá látka a druhá je složena ze směsi.
čisté látky
Čistá látka je sada pouze jednoho chemického druhu, to znamená, že není mísena s ostatními.
Jako příklad použijeme vodu. Voda (H2O) je uznáván pro své vlastnosti a specifické vlastnosti tohoto materiálu nám pomáhají jej identifikovat. Hlavní vlastnosti vody oni jsou:
| Hustota | 1,00 g / cm3 |
|---|---|
| Fúzní bod | 0 ° C |
| Bod varu | 100 ° C |
Pokud má materiál po celou dobu pevné a neměnné vlastnosti, říkáme, že je čistá látka.
Když dáme stolní sůl, chlorid sodný (NaCl), do sklenice vody a promícháme, dojde ke změně.

Výsledkem je produkt se střední hustotou mezi hustotou vody a soli. Je to proto, že voda již není čistou látkou a stala se Směs.
Při pokusu o zmrazení této směsi si všimnete, že teplota tání bude nižší než 0 ° C a tak dále také tato směs nebude vařit při 100 ° C, k jejímu odpaření bude zapotřebí více tepla produkt.
Čisté jednoduché a složené látky
Čisté látky jsou klasifikovány jako jednoduché, pokud ve svém složení obsahují atomy pouze jednoho chemického prvku.
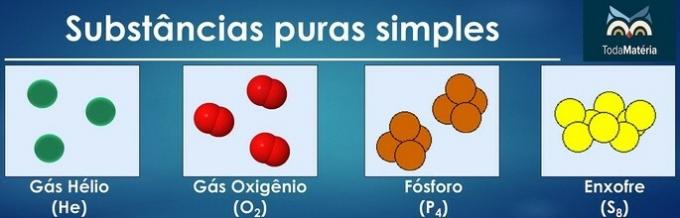
Uspořádání atomů dvou nebo více chemických prvků tvoří čisté složené látky.

Směsi
Směs odpovídá spojení dvou nebo více čistých látek, které se nazývají složky.
Na rozdíl od čistých látek nejsou jeho vlastnosti pevné, protože závisí na podílu složek ve směsi.
Podívejte se, jak se hustota, fyzikální vlastnost, liší podle množství soli smíchané s vodou.
| Procento soli v celková hmotnost směsi |
Hustota směsi (g / cm3) při 20 ° C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Zdroj: FURNISS, B. S. et al. Vogelova učebnice praktické organické chemie. 4. vyd. London: Longman, 1987. P. 1.312.
Přidání vody a soli v jakémkoli poměru má proto proměnlivou hustotu, a proto nemůžeme směs klasifikovat jako vodu nebo sůl.
Homogenní a heterogenní směsi
Homogenní směsi jsou ty, které prezentují složky pouze v jedné fázi, a proto mají ve všech bodech stejné vlastnosti.

Když vizuálně vnímáme více než jednu fázi, pak je směs klasifikována jako heterogenní.

Shrnutí čistých látek a směsí
| Čisté látky a směsi | |
|---|---|
|
homogenní systém (pouze jedna fáze) |
čistá látka (jedna složka) |
|
homogenní směs (více než jedna složka ve stejné fázi) | |
|
heterogenní systém (více než jedna fáze) |
čistá látka (součást v různých fyzikálních stavech) |
|
heterogenní směs (více než jedna složka ve více než jedné fázi) |
Chcete-li se dozvědět více, nezapomeňte zkontrolovat tyto texty:
- Atomy
- Chemické prvky
- Oddělení směsí
Cvičení s komentovanou zpětnou vazbou
1. (UFMG) U vzorku čisté látky X byly stanoveny některé jeho vlastnosti. Všechny alternativy mají vlastnosti, které jsou užitečné pro identifikaci této látky, kromě:
a) hustota.
b) hmotnost vzorku.
c) rozpustnost ve vodě.
d) teplota varu.
e) teplota tání.
Špatná alternativa: b) hmotnost vzorku.
a) SPRÁVNĚ. Hustota je množství hmoty v daném objemu. Jako vlastnost specifická pro materiál je užitečná pro identifikaci látky.
b) NESPRÁVNÉ. Hmotnost je množství hmoty v těle. Jelikož se tato vlastnost vztahuje na jakoukoli hmotu, bez ohledu na její složení, není možné ji použít k identifikaci látky.
c) SPRÁVNĚ. Rozpustnost je schopnost látky rozpouštět se v dané kapalině či nikoli. Jako vlastnost specifická pro materiál je užitečná pro identifikaci látky.
d) SPRÁVNĚ. Teplota varu odpovídá teplotě přechodu z kapalného do plynného skupenství. Jako vlastnost specifická pro materiál je užitečná pro identifikaci látky.
e) SPRÁVNĚ. Teplota tání odpovídá teplotě přechodu z kapalného do pevného stavu. Jako vlastnost specifická pro materiál je užitečná pro identifikaci látky.
2. (Vunesp) Štítek láhve minerální vody je uveden níže.
| Pravděpodobné chemické složení: |
|---|
| Síran vápenatý 0,0038 mg / l |
| Hydrogenuhličitan vápenatý 0,0167 mg / l |
Na základě těchto informací můžeme minerální vodu klasifikovat jako:
a) čistá látka.
b) jednoduchá látka.
c) heterogenní směs.
d) homogenní směs.
e) koloidní suspenze.
Správná alternativa: d) homogenní směs.
a) NESPRÁVNÉ. Voda by byla čistá, kdyby její složení mělo pouze molekuly H.2Ó.
b) NESPRÁVNÉ. Jednoduchá látka se skládá z atomů pouze jednoho chemického prvku. Čistá voda není ani jednoduchá látka, protože je tvořena atomy vodíku a kyslíku (H2O) je klasifikován jako kompozitní.
c) NESPRÁVNÉ. Heterogenní směs má více než jednu fázi, v takovém případě můžeme pozorovat pouze vodu.
d) SPRÁVNĚ. Protože má pouze jednu fázi, je systém homogenní. Při pohledu na láhev s vodou vidíme pouze kapalinu, protože sloučeniny síranu vápenatého a hydrogenuhličitanu vápenatého jsou rozpustné ve vodě, a proto jsou rozpuštěny.
e) NESPRÁVNÉ. Koloidní suspenze je heterogenní směs, jejíž složky jsou diferencovány pomocí mikroskopu.
3. (UCDB) V chemické laboratoři byly připraveny následující směsi:
I. voda / benzín
II. voda / sůl
III. voda / písek
IV. benzín / sůl
PROTI. benzín / písek
Které z těchto směsí jsou homogenní?
Ano Ne.
b) Pouze II.
c) II a III.
d) I a II.
e) II a IV.
Správná alternativa: b) Pouze II.
a) NESPRÁVNÉ. Voda je anorganická sloučenina a benzín organická sloučenina. Tyto látky nemají schopnost vzájemného působení a protože mají různé hustoty, tvoří heterogenní směs.
b) SPRÁVNĚ. Sůl, chlorid sodný, se rozpouští ve vodě za vzniku roztoku, což je homogenní směs.
c) NESPRÁVNÉ. Písek, oxid křemičitý, tvoří s vodou heterogenní směs.
d) NESPRÁVNÉ. Sůl je anorganická sloučenina a benzín organická sloučenina. Tyto látky nemají schopnost vzájemného působení a protože mají různé hustoty, tvoří heterogenní směs.
e) NESPRÁVNÉ. Písek je anorganická sloučenina a benzín organická sloučenina. Tyto látky nemají schopnost interagovat, a proto tvoří heterogenní směs.
4. (Ufes) V dobře promíchaném systému skládajícím se z písku, soli, cukru, vody a benzínu je počet fází:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Správná alternativa: b) 3.
FÁZE 1: Sůl a cukr jsou schopné interagovat s vodou a prostřednictvím mezimolekulárních sil se molekuly vážou a tvoří roztok, který je homogenní směsí.
FÁZE 2: Voda je anorganická sloučenina a benzín organická sloučenina. Tyto látky nemají schopnost vzájemného působení a protože mají různé hustoty, tvoří heterogenní směs.
FÁZE 3: Písek je křemičitan, který nemá chemickou afinitu k vodě a benzínu, a proto představuje fázi.
5. (Mackenzie) Směs tvořená:
a) kostky ledu a vodný roztok cukru (glukóza).
b) N plyny2 a CO2.
c) voda a aceton.
d) voda a angreštový sirup.
e) petrolej a nafta.
Správná alternativa: a) kostky ledu a vodný roztok cukru (glukóza).
a) SPRÁVNĚ. Lze pozorovat dvě fáze: kostky ledu a roztok glukózy, takže se jedná o heterogenní systém.
b) NESPRÁVNÉ. Plyny jsou vždy homogenní směsí.
c) NESPRÁVNÉ. Mezi karbonylem propanonu a molekulou vody se tvoří vodíkové vazby. Jelikož se jedná o polární látky, je aceton schopen solubilizovat ve vodě a vytvářet homogenní směs.
d) NESPRÁVNÉ. Tyto dvě složky se mísí a vytvářejí homogenní systém, protože z angreštového sirupu uvidíme pouze červenou tekutinu, protože k ředění dochází přidáním vody.
e) NESPRÁVNÉ. Obě jsou organické sloučeniny a díky chemické afinitě tvoří jednu fázi, která představuje homogenní systém.
Otestujte si své znalosti pomocí cvičení:
- Cvičení na homogenní a heterogenní směsi
- Cvičení k oddělování směsí
- Cvičení z vlastností hmoty


