Test Enem Sciences a jeho technologie se skládá z 45 objektivních otázek výběr z více možností v celkové hodnotě 100 bodů. V něm konkrétní znalosti o Biologie, fyzika a chemie.
Níže uvádíme seznam a krátké shrnutí předmětů, které zahrnují různé obsahy, které v testu přírodních věd a jeho technologií spadají nejvíce.
Biologie
Molekuly, buňky a tkáně
- Buňka: Nejmenší jednota živých bytostí s definovanými formami a funkcemi.
- buněčná teorie: Tvrdí, že všechny živé bytosti jsou tvořeny buňkami.
- Buněčné organely: Jsou jako malé orgány, které provádějí základní činnosti pro buňky.
- Buněčné jádro: Kde se nachází genetický materiál (DNA) organismů a je přítomen v eukaryotických buňkách.
- buněčné dělení: Proces, při kterém z mateřské buňky vznikají dceřiné buňky.
- Metabolismus: Sada chemických reakcí, které probíhají v buňce a umožňují jí zůstat naživu, růst a dělit se.
- Proteosyntéza: Mechanismus produkce bílkovin.
- Histologie: Studium biologických tkání analyzujících jejich strukturu, původ a diferenciaci.
- Cytologie: Odvětví biologie, která studuje buňky a jejich struktury.
- Biotechnologie: Využití technologií k vytvoření nebo úpravě živých organismů.
Dědičnost a rozmanitost života
- Dědičnost: Biologický mechanismus, při kterém se vlastnosti každé živé bytosti přenášejí z jedné generace na druhou.
- Geny a chromozomy: Geny jsou malé struktury tvořené DNA. Sada těchto struktur zase tvoří chromozomy.
- Mendelovy zákony: Jsou souborem základů, které vysvětlují mechanismus dědičného přenosu po generace.
- Úvod do genetiky: Základní pojmy v oblasti biologie, která studuje mechanismy dědičnosti nebo biologické dědičnosti.
- Genetická variabilita: Odkazuje na variace genů mezi jednotlivci v populaci.
- genetické inženýrství: Techniky manipulace a rekombinace genů, které přeformulují, rekonstituují, reprodukují a dokonce vytvářejí živé bytosti.
- krevní skupiny: Nejdůležitější jsou ABO System a Rh Factor.
- Systém ABO a faktor Rh: Systém ABO klasifikuje lidskou krev do čtyř existujících typů: A, B, AB a O. Na druhé straně faktor Rh je skupina antigenů, která určuje, zda má krev pozitivní nebo negativní Rh.
Identita živých bytostí
- klasifikace živých bytostí: Systém, který organizuje živé bytosti do kategorií podle jejich společných charakteristik a evolučních příbuzenských vztahů.
- Virus: Jsou to infekční agens, mikroskopičtí a nebuněční (nemají buňky).
- prokaryotické buňky: Nemají uvnitř jadernou membránu ani membránové struktury.
- eukaryotické buňky: Skládá se z plazmatické membrány, cytoplazmy a jádra.
- Autotrofy a heterotrofy: Autotrofy jsou živé bytosti, které získávají živiny a energii pomocí slunečního světla prostřednictvím fotosyntézy, zatímco heterotrofy získávají živiny a energii a spotřebovávají jiné živé bytosti.
- Fylogeneze: Jedná se o genealogickou historii druhu a jeho hypotetické vztahy mezi předky a potomky.
- Embryologie: Studujte všechny fáze embryonálního vývoje od oplodnění, tvorby zygoty až do úplného vytvoření všech orgánů nové bytosti.
- Anatomie člověka: Studujte struktury těla, jak se formují a jak spolupracují v těle (systémy).
- Fyziologie: Studium mnoha chemických, fyzikálních a biologických funkcí, které zaručují správné fungování organismů.
Ekologie a vědy o životním prostředí
- ekosystém: Soubor tvořený biotickými společenstvími a abiotickými faktory, které v dané oblasti interagují
- Brazilské ekosystémy: Hlavními brazilskými ekosystémy jsou: Amazon, Caatinga, Cerrado, Atlantický les, Mata dos Cocais, Pantanal, les Araucaria, Mangue a Pampas.
- Biotické a abiotické faktory: Fyzikální a chemické prvky prostředí (abiotické faktory) do značné míry určují strukturu a fungování živých komunit (biotické faktory).
- Stanoviště a ekologická nika: Prostředí je místem, kde zvíře žije, a nika je tím, jak tam žije.
- web s potravinami: Sada potravinových řetězců propojených v ekosystému.
- Potravní řetězec: Odpovídá stravovacímu vztahu, tj. Absorpci živin a energie mezi živými bytostmi.
- ekologické pyramidy: Toto jsou grafická znázornění trofických interakcí mezi druhy v komunitě.
- Biogeochemické cykly: Představuje pohyb chemických prvků mezi živými bytostmi a atmosférou planety, litosférou a hydrosférou.
- Biomy světaAtrakce: Existuje sedm hlavních: Tundra, Tajga, Mírný les, Tropický les, Savanny, Prairie a Poušť.
- Brazilské biomy: Je jich šest: Amazon, Cerrado, Caatinga, Atlantic Forest, Pantanal a Pampa.
- Přírodní zdroje: Jedná se o prvky nabízené přírodou, které používá člověk k přežití.
- Změny klimatu: Změny klimatu na celé planetě.
- skleníkový efekt a globální oteplování: Skleníkový efekt je přirozený proces, který je zesílen lidskou činností a způsobuje globální oteplování.
Vznik a vývoj života
- Původ života: Vysvětleno několika teoriemi vyvinutými při hledání odpovědí.
- Abiogeneze a biogeneze: Dvě teorie formulované k vysvětlení původu života na Zemi.
- Co je vesmír?: Odpovídá množině veškeré existující hmoty a energie.
- Teorie velkého třesku: Myslí si, že vesmír se vynořil z exploze jediné částice - pravěkého atomu - způsobující kosmickou kataklyzmu.
- Vývoj: Odpovídá procesu modifikace a adaptace druhů v průběhu času.
- Lidská evoluce: Odpovídá procesu změn, který vedl k lidským bytostem a odlišil je jako druh.
- Evoluční teorie: Současné druhy pocházejí z jiných druhů, které v průběhu času prošly změnami a přenesly nové vlastnosti na své potomky.
- darwinismus: Jedná se o soubor studií a teorií souvisejících s vývojem druhů vyvinutých anglickým přírodovědcem Charlesem Darwinem.
- Neodarwinismus: Jedná se o moderní evoluční teorii, která je založena na evolučních studiích Charlese Darwina, spolu s objevy genetiky.
- Přírodní výběr: Vyskytuje se kvůli potřebě přežití a přizpůsobení druhů prostředí.
Kvalita života lidských populací
- Index lidského rozvoje (HDI): Hodnocení vývoje lidstva na základě informací o kvalitě života a ekonomice území.
- Společenská nerovnost: Sociální problém, ve kterém je nepřiměřenost životní úrovně obyvatel.
- Hrubý domácí produkt (HDP): Způsob měření produkce v určitém časovém období.
- STD - sexuálně přenosné nemoci: Jedná se o nemoci, které se mohou přenášet z jedné osoby na druhou sexuálním kontaktem.
- léky: Jedná se o látky, které mění funkce těla a chování lidí
- Těhotenství mladistvých: Podle WHO se uvažuje o těhotenství, ke kterému dochází mezi 10 a 19 lety.
- Sociální problémy Brazílie: Mezi hlavní patří: nezaměstnanost, zdraví, vzdělání, bydlení, násilí a znečištění.
- Význam fyzické aktivity pro zdraví: Zlepšuje kvalitu života a v kombinaci s vyváženou stravou vede ke zdravému tělu a předchází nemocem.
- Zdravé stravování: Spotřeba potravin s rozmanitostí, umírněností a vyvážeností.
Problémy biologie, které spadly do Enemu
1. (Enem / 2016) Proteiny eukaryotické buňky mají signální peptidy, které jsou sekvencemi aminokyseliny odpovědné za jejich adresování různým organelám, podle jejich funkce. Výzkumník vyvinul nanočástice schopné přenášet proteiny do konkrétních typů buněk. Nyní chce vědět, jestli nanočástice nabitá proteinem blokujícím Krebsův cyklus in vitro je schopen vykonávat svoji aktivitu v rakovinné buňce, je schopen snížit dodávku energie a zničit tyto buňky.
Při výběru tohoto blokujícího proteinu pro vložení nanočástic musí výzkumník vzít v úvahu adresovací signální peptid, na kterou organelu?
a) Jádro.
b) Mitochondrie.
c) Peroxisom.
d) Golgiense komplex.
e) Endoplazmatické retikulum.
Správná alternativa: b) Mitochondrie.
K získávání energie dochází rozbitím vazeb molekul.
Prostřednictvím aerobního dýchání, to znamená v přítomnosti kyslíku, má glukóza rozbité vazby ve třech fázích:
- Glykolýza
- Krebsův cyklus
- Oxidační fosforylace
První krok probíhá v cytosolu, zatímco další dva kroky probíhají v mitochondriích.
Mitochondrie tedy mají funkci provádění buněčného dýchání, které produkuje většinu energie použité v buněčných funkcích.
Signální peptid musí být směrován do mitochondrií, protože blokováním Krebsova cyklu je možné přerušit dodávku energie a zničit buňky.
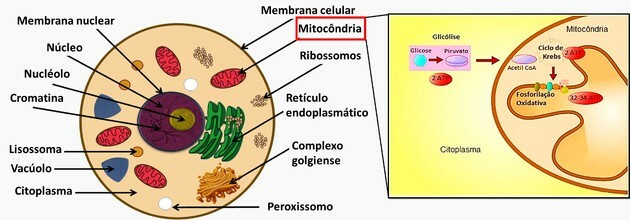
Cytoplazma je objemná oblast, která obsahuje jádra a buněčné organely.
Jádro obsahuje genetický materiál (DNA a RNA).
Organely fungují jako orgány v buňkách a každá z nich vykonává určitou funkci.
Funkce dalších organel přítomných v alternativách otázek jsou:
- Endoplazmatické retikulum: funkcí hladkého endoplazmatického retikula je produkce lipidů, které budou tvořit buněčné membrány, zatímco hrubé endoplazmatické retikulum má funkci provádět syntézu protein.
- Komplex golgi: hlavní funkcí komplexu golgi je modifikace, ukládání a export proteinů syntetizovaných v drsném endoplazmatickém retikulu.
- Peroxisomy: funkcí je oxidace mastných kyselin pro syntézu cholesterolu a buněčné dýchání.
2. (Enem / 2017) Šedí delfíni (Sotalia guianensis), savci z čeledi delfínů, jsou vynikajícími indikátory znečištění v oblastech, kde žijí, protože tráví celý svůj život - přibližně 30 let - ve stejné oblasti. Kromě toho tento druh hromadí ve svém těle více kontaminantů, jako je rtuť, než jiná zvířata ve svém potravinovém řetězci.
MARCOLINO, B. Strážci moře. K dispozici v: http://cienciahoje.uol.com.br. Datum přístupu: 1. srpna 2012 (přizpůsobený).
Šedí delfíni akumulují vyšší koncentraci těchto látek, protože:
a) jsou býložravá zvířata.
b) jsou detritivorní zvířata.
c) jsou velká zvířata.
d) trávit jídlo pomalu.
e) jsou na vrcholu potravinového řetězce.
Správná alternativa: e) jsou na vrcholu potravinového řetězce.
Je možné zjistit o ekosystému, kde žijí šedí delfíni, protože tato zvířata tráví život ve stejné oblasti. Proto jakékoli změny, které lze u těchto zvířat pozorovat, pocházejí ze změn v místě, kde žijí.
V potravinovém řetězci se jedna bytost stává potravou jiné, což demonstruje interakce druhů v určitém místě.
Složky potravinového řetězce jsou vkládány na trofické úrovně, které odpovídají pořadí, ve kterém jsou vstřebávány živiny a energie získávána mezi živými bytostmi.
V ekosystému, ve kterém sviňucha žije, je vložen do horní části potravinového řetězce.
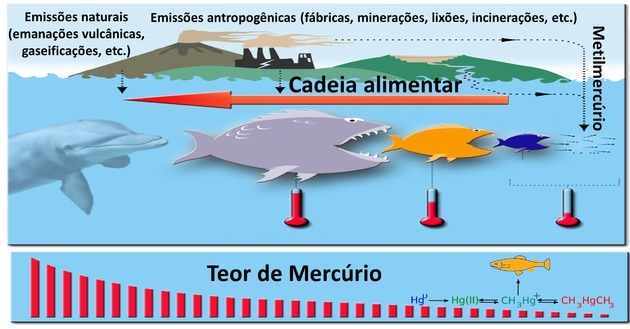
Když se delfín krmí, zvířata přítomná v předchozích trofických úrovních již absorbovala několik dalších organismů.
Těžké kovy, jako je rtuť, nejsou biologicky odbouratelné a vyskytují se v průmyslových činnostech, sopkách, elektronickém odpadu a dolech.
K bioakumulaci dochází, když se tyto toxické látky postupně hromadí v trofických úrovních. Nejvyšší obsah rtuti bude tedy nalezen na nejvzdálenějších trofických úrovních.
Koncentrace tohoto kovu bude vyšší u dravce delfínů než u jeho kořisti, například ryb, krevet a chobotnic.
Ačkoli jde o velká zvířata, není to důvodem pro bioakumulaci a pomalé trávení to neruší, protože rtuť není biologicky odbouratelná.
Bylinožravá zvířata konzumují autotrofní bytosti, jako jsou řasy, zatímco detritivores se živí organickým odpadem.
Podívejte se také:Biology in Enem.
3. (Enem / 2017) Atlantický les je charakterizován velkou rozmanitostí epifytů, jako jsou bromélie. Tyto rostliny jsou přizpůsobeny tomuto ekosystému a jsou schopné zachytit světlo, vodu a živiny i na stromech.
K dispozici na: www.ib.usp.br. Přístup: 23. února 2013 (přizpůsobený).
Tyto druhy zachycují vodu z (a)
a) organismus sousedních rostlin.
b) půda skrz její dlouhé kořeny.
c) mezi jeho listy se nahromadil déšť.
d) surová míza hostitelských rostlin.
e) komunita, která žije ve svém nitru.
Správná alternativa: c) mezi jeho listy se nahromadil déšť.
Ekologické vztahy ukazují vztahy mezi živými bytostmi a prostředím, ve kterém žijí, a určují, jak přežívají a rozmnožují se.
Epifytismus je harmonický ekologický vztah mezi dvěma druhy, kde druh, jako je bromeliad, používá stromy k získání úkrytu, aniž by mu ublížil.
Vzhledem k tomu, že mají různé velikosti, nacházejí bromeliady ochranu na površích větších stromů a fixují své kořeny na hostitelském stromu.
Tvar listů umožňuje akumulaci dešťové vody a mikroskopické váhy podporují vstřebávání vody a živin.
Kořeny bromeliad se používají pouze k připoutání k rostlinám, čímž se vytváří vztah nájemníků, ve kterém epifyt prospívá, ale stromu neškodí.
Pro další otázky týkající se Biology on Enem jsme připravili tento seznam: Problémy biologie v Enem.
Fyzika
energie, práce a síla
- práce ve fyzice: Přenos energie v důsledku působení síly.
- Energie: Představuje schopnost produkovat práci.
- Druhy energie: Mechanické, tepelné, elektrické, chemické a jaderné.
- Kinetická energie: Energie spojená s pohybem těl.
- Potenciální energie: Energie související s polohou těles.
- Síla: Akce vyvíjená na tělo schopné změnit klidový stav nebo změnit množství pohybu.
- Elektrická energie: Jak rychle je práce hotová.
- Elektrický potenciál: Práce elektrické síly na elektrifikovaném náboji při pohybu mezi bodem ve vztahu k referenčnímu bodu.
- Fyzikální vzorce: Vztahy mezi veličinami podílejícími se na stejném fyzikálním jevu.
Mechanika, pohybové studie a Newtonovy právní aplikace
- Množství pohybu: Vektorové množství definované jako součin hmotnosti tělesa a jeho rychlosti.
- jednotný pohyb: Představuje posunutí těla z daného referenčního rámce při konstantní rychlosti.
- rovnoměrný pohyb: Rychlost je v průběhu času konstantní a je nenulová.
- Rovnoměrný přímočarý pohyb: Tělo je pod konstantní rychlostí, trajektorie, kterou tělo prochází, je však přímá.
- Rovnoměrně variabilní přímočarý pohyb: Provádí se přímočaře a má změnu rychlosti vždy ve stejných časových intervalech.
- Newtonovy zákony: Základní principy používané k analýze pohybu těl.
- Gravitace: Základní síla, která reguluje objekty v klidu.
- Setrvačnost: Vlastnost hmoty, která označuje odpor ke změně.
Vlnové jevy a vlny
- vlny: Poruchy, které se šíří vesmírem bez transportu hmoty, pouze energie.
- mechanické vlny: Poruchy, které přenášejí kinetickou a potenciální energii materiálním médiem.
- Elektromagnetické vlny: Výsledky společného uvolňování zdrojů elektrické a magnetické energie.
- Zvukové vlny: Jedná se o vibrace, které vytvářejí sluchové vjemy, když pronikají do našeho ucha.
- gravitační vlny: Jsou to vlnky v zakřivení časoprostoru, které se šíří prostorem.
Elektrické a magnetické jevy
- Elektřina: Oblast fyziky, která studuje jevy způsobené prací elektrických nábojů.
- elektrostatika: Studujte elektrické náboje bez pohybu, tj. V klidovém stavu.
- Elektrodynamika: Studujte dynamický aspekt elektřiny, tj. Konstantní pohyb elektrických nábojů.
- Elektromagnetismus: Studuje vztah mezi silami elektřiny a magnetismu jako jedinečný fenomén.
- Elektrifikační procesy: Metody, kdy tělo již není elektricky neutrální a nabije se kladně nebo záporně.
- Ohmovy zákony: Určete elektrický odpor vodičů.
- Kirchhoffovy zákony: Určete sílu proudů v elektrických obvodech, kterou nelze snížit na jednoduché obvody.
Tepelné a tepelné jevy
- teplo a teplota: Teplo označuje výměnu energie mezi těly, zatímco teplota charakterizuje míchání molekul v těle.
- šíření tepla: Přenos tepla, ke kterému může dojít vedením, konvekcí nebo zářením.
- termometrické váhy: Používají se k označení teploty, tj. Kinetické energie spojené s pohybem molekul.
- Kalorimetrie: Studuje jevy související s výměnami tepelné energie.
- měrné teplo: Fyzikální veličina vztahující se k množství přijatého tepla a jeho tepelným změnám.
- citelné horko: Fyzikální veličina, která souvisí s kolísáním teploty těla.
- latentní teplo: Fyzikální veličina, která označuje množství tepla přijatého nebo vydaného tělem, zatímco se jeho fyzický stav mění.
- tepelná kapacita: Množství, které odpovídá množství tepla přítomného v těle ve vztahu k teplotním změnám, kterým trpí.
- Termodynamika: Oblast fyziky, která studuje přenosy energie.
Optika, optické jevy, lom světla
- Světlo: Elektromagnetické vlny citlivé na pouhé oko.
- lom světla: Optický jev, ke kterému dochází, když světlo prochází změnou propagačního média.
- odraz světla: Optický jev dopadajícího světla na odrazný povrch, vracející se k výchozímu bodu.
- Rychlost světla: Rychlost, s jakou se světlo pohybuje ve vakuu a šíří se v různých médiích.
Hydrostatika
- Hydrostatika: Vlastnosti kapaliny, jako je hydrostatický tlak, hustota a vztlaková síla.
- hydrostatický tlak: Koncept a vzorce pro výpočet hydrostatického tlaku a celkového tlaku.
- Stevinova věta: Vztah mezi změnami tlaku atmosférického a kapalného.
- Archimédova věta: Výpočet výsledné síly vyvíjené tekutinou na dané těleso (vztlaková věta).
Problémy fyziky, které spadly do Enemu
1. (Enem / 2017) Pojistka je nadproudová ochrana v obvodech. Pokud je proud procházející touto elektrickou součástí větší než maximální jmenovitý proud, pojistka se přepálí. Tímto způsobem zabraňuje vysokému proudu poškození obvodových zařízení. Předpokládejme, že zobrazený elektrický obvod je napájen zdrojem napětí U a že pojistka podporuje jmenovitý proud 500 mA.
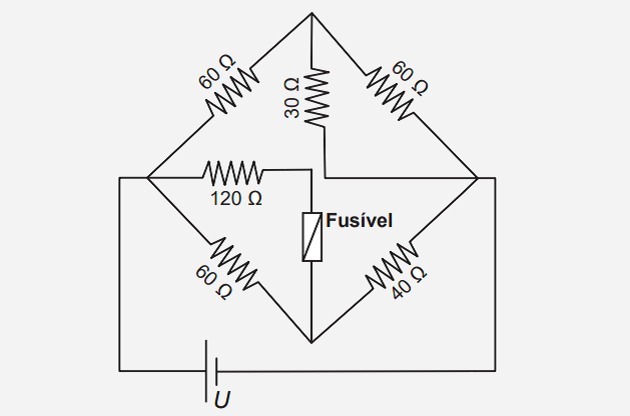
Jaká je maximální hodnota napětí U takže pojistka nefoukne?
a) 20 V
b) 40 V
c) 60V
d) 120 V
e) 185 V
Správná alternativa: d) 120 V
Obvod navržený v otázce je tvořen smíšeným sdružením rezistorů. Víme také, že maximální proud podporovaný pojistkou je 500 mA (0,5 A).
Abychom zjistili maximální hodnotu napětí baterie, můžeme izolovat část obvodu, kde je umístěna pojistka, jak je znázorněno na obrázku níže.
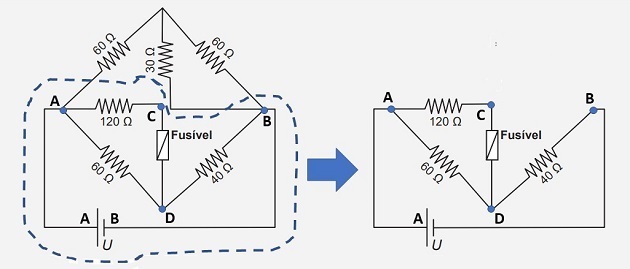
To je možné, protože „horní“ část obvodu je vystavena stejnému napětí jako „spodní“ část (zvýrazněná část na obrázku), protože její svorky jsou připojeny ke stejným bodům (A a B).
Začněme hledáním hodnoty napětí na 120 svorkách rezistoru. Proud, který prochází tímto rezistorem (tj1) je stejný, který prochází pojistkou. Proto máme:
UPŘED NAŠÍM LETOPOČTEM= 0,5 120 = 60 V
Bude to stejné napětí jako 60 svorek rezistoru. jsou vystaveny, protože je zapojen paralelně s odporem 120.
.
Můžeme tedy najít aktuální hodnotu (tj2), který prochází tímto rezistorem:
Aktuální i3 který protíná odpor 40 se rovná součtu i1 Ahoj2, tj:
i3 = 1 + 0,5 = 1,5 A
Známe-li tuto hodnotu, můžeme vypočítat hodnotu napětí na svorkách rezistoru 40 :
Udb= 1,5.40 = 60V
Napětí obvodu se tedy bude rovnat součtu UPŘED NAŠÍM LETOPOČTEM s teboudb, to znamená:
U = 60 + 60 = 120 V
2. (Enem / 2017) V některých domácnostech se používají elektrifikované ploty, aby se zabránilo možným útočníkům. Elektrifikovaný plot pracuje s rozdílem elektrického potenciálu přibližně 10 000 V. Aby nebyl smrtelný, nesmí být proud, který lze přenášet osobou, větší než 0,01 A. Elektrický odpor těla mezi rukama a nohama osoby je kolem 1 000 1.
Aby proud nebyl smrtelný pro osobu dotýkající se elektrifikovaného plotu, musí mít generátor napětí vnitřní odpor, který je ve srovnání s odporem lidského těla
a) prakticky nulové.
b) přibližně stejné.
c) tisíckrát větší.
d) řádově 10krát větší.
e) běh 10krát menší.
Správná alternativa: c) tisíckrát větší.
Abychom tento problém vyřešili, musíme porovnat vnitřní odpor generátoru s odporem lidského těla. K tomu použijeme následující rovnice:
(rovnice generátoru)
U = R.i (Ohmův zákon)
Všimněte si, že r je vnitřní odpor generátoru a R se rovná odporu těla. Rovnicí dvou rovnic a dosazením hodnot máme:
Nyní musíme zjistit, kolikrát musí být vnitřní odpor generátoru větší než odpor těla. Rozdělme tedy jeden po druhém, to znamená:
Proto by měl být vnitřní odpor generátoru asi 1000krát větší než odpor těla dané osoby.
3. (Enem / 2017) Řidič, který odpoví na hovor z mobilního telefonu, je veden k nepozornosti, což zvyšuje možnost nehody v důsledku prodloužení jeho reakční doby. Zvažte dva řidiče, první pozorný a druhý, kteří při řízení používají mobilní telefon. Zrychlují svá auta zpočátku na 1,00 m / s2. V reakci na nouzovou situaci zabrzdili se zpomalením rovným 5,00 m / s2. Pozorný řidič zabrzdí rychlostí 14,0 m / s, zatímco nepozornému řidiči v podobné situaci trvá brzdění déle o 1,00 sekundy.
Jak daleko cestuje nepozorný řidič více než pozorný řidič, dokud se auta úplně nezastaví?
a) 2,90 m
b) 14,0 m
c) 14,5 m
d) 15,0 m
e) 17,4 m
Správná alternativa: e) 17,4 m
Najdeme vzdálenost ujetou 1. řidičem pomocí Torricelliho rovnice, tedy:
proti2 = v02 + Pondělí
Počáteční rychlost prvního vozu se rovná 14 m / s, jeho konečná rychlost se rovná nule, protože vůz se zastavil a jeho zrychlení se rovná - 5 m / s2. Dosazením těchto hodnot do rovnice máme:
Nyní se podívejme na situaci druhého řidiče. Jelikož mu trvalo 1 s déle, než narazil na brzdu, vzdálenost uraženou v tomto časovém intervalu lze zjistit pomocí rovnice:
v = v0 + at
Vzhledem k tomu, že jeho zrychlení bylo 1 m / s2 a že jeho počáteční rychlost byla také 14 m / s, zjistili jsme:
v = 14 + 1,1 ⇒ v2 = 15 m / s
Chcete-li zjistit vzdálenost ujetou v tomto časovém intervalu, použijeme Torricelliho rovnici:
Při použití brzdy byla jeho rychlost rovna 15 m / s a její zrychlení rovné -5 m / s2. K nalezení ujeté vzdálenosti k zastavení použijeme opět Torricelliho rovnici:
Celková vzdálenost ujetá druhým vozem se bude rovnat:
na2 = Δs '+ Δs "
na2 = 14,5 + 22,5
na2 = 37,0 m
Chcete-li zjistit vzdálenost, kterou nepozorný řidič urazil nejvíce, postupujte takto:
37,0 - 19,6 = 17,4 m
Podívejte se také:Fyzika v Enem.
Chemie
chemické transformace
- chemické transformace: Akce, které vedou k tvorbě nových látek
- Chemické vazby: Spojení mezi atomy stejných nebo různých prvků.
- Chemické reakce: Přeskupení atomů za vzniku nových látek.
- Chemická rovnováha: Fenomén, který se vyskytuje v reverzibilních chemických reakcích, kdy jsou rychlost přímé a inverzní reakce stejná.
- Atomové modely: Spojují atomové modely Daltona, Thomsona, Rutherforda a Bohra.
- atomová struktura: Skládá se ze tří základních částic: protony (s kladným nábojem), neutrony (neutrální částice) a elektrony (se záporným nábojem).
- Chemické prvky: Základní prvek hmoty složený ze skupiny atomů se stejným atomovým číslem.
- Periodická tabulka: Klasifikace chemických prvků ve vzestupném pořadí podle atomového čísla.
- Stechiometrické výpočty: Kvantitativní analýza složení látek spotřebovaných a vytvořených při chemické reakci.
Materiály, jejich vlastnosti a použití
- vlastnosti hmoty: Fyzikální nebo chemické vlastnosti tvořící materiály.
- fyzikální stavy hmoty: Pevná látka, kapalina, plyn, plazma a Bose-Einsteinův kondenzát.
- Změny fyzikálního stavu: Jedná se o kondenzaci nebo zkapalnění, tuhnutí, fúzi, odpařování a sublimaci.
- ion, kation a anion: Ion je elektricky nabitá chemická látka. Kation má kladný náboj, anion záporný náboj.
- mezimolekulární síly: Síly vyvíjené k udržení dvou nebo více molekul pohromadě.
- Molekula: Je to stabilní seskupení dvou nebo více stejných nebo různých atomů spojených kovalentními vazbami.
- Molekulární geometrie: Je to způsob, který ukazuje, jak se atomy uspořádají v molekule.
- molekulární vzorec: Jedná se o vyjádření chemických symbolů a indexů složek molekuly.
- strukturní vzorec: Představuje, jak se atomy spojují.
Voda
- Voda: Jeden z nejdůležitějších přírodních zdrojů pro lidstvo. Skládá se z jednoho atomu kyslíku a dvou atomů vodíku.
- vlastnosti vody: Je to vynikající rozpouštědlo, protože je schopné rozpouštět obrovské množství látek.
- hustota vody: Je to 1 g / cm3 (zní: jeden gram na kubický centimetr). Tato hodnota odpovídá vodě při 25 ° C.
- důležitost vody: Voda je zdrojem života na planetě. V tomto smyslu je při nedostatku vody ohrožen život.
- Fyzikální stavy vody: Nachází se v přírodě ve třech fyzikálních skupenstvích: kapalném, pevném a plynném.
chemické roztoky
- chemické roztoky: Jsou to homogenní směsi tvořené dvěma nebo více látkami.
- Koloidní roztoky: Jedná se o směsi, které vykazují vzhled homogenní směsi vzhledem k velikosti dispergovaných částic mezi 1 a 100 nm.
- Rozpustnost: Fyzikální vlastností látek je rozpouštět se v dané kapalině či nikoli.
- Koncentrace řešení: Odpovídá množství rozpuštěné látky přítomné v daném množství rozpouštědla.
- Ředění roztoků: Skládá se z přidání rozpouštědla do roztoku beze změny množství rozpuštěné látky.
Sloučeniny a chemické látky
- Kyseliny: Jedná se o látky, které ve vodném roztoku uvolňují pozitivní ionty vodíku nebo protony.
- Základny: Jedná se o látky vzniklé spojením kationtu a aniontu, které uvolňují hydroxylové ionty (anionty OH–) ve vodném roztoku.
- soli: Soli jsou výsledkem reakce kyseliny s bází.
- Oxidy: Jedná se o binární iontové nebo molekulární sloučeniny, kde jsou molekuly kyslíku spojeny s jinými prvky.
Chemické transformace a energie
- termochemie: Je to část chemie, která studuje zapojení množství tepla (energie) do chemických reakcí.
- Endotermické a exotermické reakce: Množství tepla absorbovaného nebo uvolněného během chemických reakcí.
- entalpie: Je to energie vyměňovaná v reakcích absorpce a uvolňování energie.
- Hessův zákon: Změna entalpie (ΔH) v chemické reakci závisí pouze na počátečním a konečném stavu reakce, bez ohledu na počet reakcí.
- Elektrochemie: Jedná se o oblast chemie, která studuje reakce, které zahrnují přenos elektronů a interkonverzi chemické energie na energii elektrickou.
- Elektrolýza: Nespontánní chemická reakce zahrnující oxidačně-redukční reakci, která je způsobena elektrickým proudem.
- Faradayův zákon: Pokud dojde k variaci magnetického toku obvodem, vznikne v něm indukovaná elektromotorická síla.
- Radioaktivita: Jaderný jev, který je výsledkem emise energie atomy a je způsoben rozpadem nebo nestabilitou chemických prvků.
- Jaderné štěpení: Jedná se o proces dělení nestabilního atomového jádra na další stabilnější jádra.
- Jaderná fůze: Jedná se o spojení atomů, které mají lehká jádra. Spojení těchto atomů má za následek atom s těžším jádrem.
sloučeniny uhlíku
- Organická chemie: Odvětví chemie, které studuje sloučeniny uhlíku, které jsou tvořeny atomy uhlíku.
- Organické funkce: Klasifikace skupin organických sloučenin s podobnými vlastnostmi.
- uhlíkové řetězce: Struktura organických sloučenin podle uspořádání atomů a vazeb.
- Uhlovodíky: Sloučeniny tvořené uhlíkem a vodíkem obecného vzorce C.XHy.
- Anorganická chemie: Odvětví chemie, které studuje látky tvořené chemickými prvky, kromě uhlíku.
- Anorganické funkce: Skupiny anorganických sloučenin, které mají podobné vlastnosti.
Vztahy chemie s technologiemi, společností a životním prostředím
- Znečištění: Zavádění látek nebo energie náhodně nebo úmyslně do životního prostředí s negativními důsledky pro živé bytosti.
- Druhy znečištění: Druhy závisí na ovlivněném zdroji a typu vytvářeného odpadu, hlavní jsou: vzduch, půda, voda, termální, zvuková, světelná, vizuální a radioaktivní.
- Ozónová vrstva: Jedná se o vrstvu ozonového plynu přítomnou ve stratosféře, která chrání planetu před škodlivým ultrafialovým zářením pro živé bytosti.
- průmyslový odpad: Vychází z procesů vyvinutých v průmyslových odvětvích, to znamená ze sekundárního sektoru.
Chemické energie v každodenním životě
- Ropa: Přírodní látka složená z několika organických složek, zejména uhlovodíků.
- Zemní plyn: Vzniká rozkladem organické hmoty v podzemních usazeninách smíchaných s ropou nebo bez ní. Skládá se ze směsi metanu ve větším množství a dalších dalších alkanů kromě CO2, H2Y a N2.
- Nerostné uhlí: Jedná se o neobnovitelný přírodní zdroj pocházející z rostlinných zbytků po miliony let.
- Fosilní paliva: Jedná se o neobnovitelné přírodní zdroje pocházející z organických nečistot nahromaděných v zemské kůře po miliony let.
- biomasa: Veškerá organická hmota rostlinného nebo živočišného původu používaná při výrobě energie.
- Biopaliva: Je to veškerý materiál používaný k výrobě energie z organické biomasy.
- Obnovitelná energie: Je to energie získaná ze zdrojů, které se regenerují spontánně nebo prostřednictvím adekvátní lidské intervence.
Chemické problémy, které v Enemu padly
1. (Enem / 2016) V polovině roku 2003 zemřelo v Brazílii více než 20 lidí po požití suspenze síranu barnatého použitého jako kontrast při radiologických vyšetřeních. Síran barnatý je velmi špatně rozpustná pevná látka, která se nerozpouští ani za přítomnosti kyselin. K úmrtí došlo proto, že farmaceutická laboratoř dodala produkt kontaminovaný uhličitanem barnatým, který je rozpustný v kyselém prostředí. Tragédii mohl odvrátit jednoduchý test na kontrolu rozpustných iontů barnatého. Tato zkouška spočívá v ošetření vzorku vodným roztokem HCl a po filtraci za účelem oddělení nerozpustných sloučenin baria se přidá vodný roztok H2POUZE4 na filtrátu a pozorováno po dobu 30 minut.
TURBINO, M.; SIMONI, J.A. Reflecting on the Celobar® case. New Chemistry, no. 2, 2007 (přizpůsobený).
Přítomnost rozpustných barnatých iontů ve vzorku je indikována
a) uvolňování tepla.
b) změna barvy na růžovou.
c) vysrážení bílé pevné látky.
d) tvorba plynného dusíku.
e) těkavost plynného chloru.
Správná alternativa: c) vysrážení bílé pevné látky.
Síran barnatý, používaný při zkouškách jako kontrast kvůli jeho nízké rozpustnosti, je vylučován tělem. Uhličitan barnatý zvýšil rozpustnost v kyselém prostředí.
Náš organismus produkuje žaludeční šťávu, aby udržel kyselost žaludku a podporoval působení enzymů při trávení.
Kyselinou přítomnou v těle je kyselina chlorovodíková, která zvyšuje rozpustnost uhličitanu barnatého a následně jeho smrt v důsledku absorpce barnatých iontů.
1. krok: určit vzorce sloučenin uvedených v textu.
| Sloučenina | Kation | anion | Vzorec |
| Síran barnatý | Ba2+ | POUZE42- | BASO4 |
| uhličitan barnatý | Ba2+ | CO32- | Slezina3 |
2. krok: reakce dvojité výměny s HCl.
V tomto typu reakce, když dvě sloučeniny reagují navzájem, si vyměňují prvky nebo radikály následujícím způsobem:
V této fázi je jediným, kdo reaguje s kyselinou, uhličitan barnatý.
Kyselina uhličitá je slabá a nestabilní kyselina, která vzniká ředěním oxidu uhličitého ve vodě.
Reakce dvojité výměny s kyselinou chlorovodíkovou je pak:
Proto se může uvolňovat oxid uhličitý.
3. krok: reakce dvojité výměny s H2POUZE4.
Při provádění filtrace se ve filtru zachytí síran barnatý, který nezreagoval, a rozpustná sůl chloridu barnatého se odfiltruje.
Po přidání kyseliny sírové do roztoku dojde k reakci:
Počáteční roztok indikuje přítomnost uhličitanu barnatého, protože test vedl k tvorbě síranu barnatého, bílé sraženiny.
Podívejte se také:Chemistry in Enem.
2. (Enem / 2017) Hlavní bod obratu v moderní historii zemědělství nastal po druhé světové válce. Po válce čelily vlády obrovskému přebytku dusičnanu amonného, přísady používané při výrobě výbušnin. Odtamtud byly továrny na munici upraveny tak, aby začaly vyrábět hnojiva s dusičnany jako hlavní složkou.
SOUZA, F. THE. Přírodní / organické zemědělství jako nástroj biologické fixace a udržování dusíku v půdě: udržitelný model CDM. K dispozici na: www.planetaorganico.com.br. Datum přístupu: 17. července 2015 (přizpůsobený).
V cyklu přírodního dusíku se ekvivalent hlavní složky těchto průmyslových hnojiv vyrábí v kroku
a) nitrace.
b) nitrosace.
c) amonifikace.
d) denitrifikace.
e) biologická fixace N2.
Správná alternativa: a) nitrace.
Dusík je plyn, který je ve vzduchu přítomen ve velkém množství.
Pak2 atmosférický je velmi stabilní díky trojné vazbě, která váže dusíky, a proto není chemicky reaktivní.
Dusík je pro živé bytosti velmi důležitý, protože je součástí biochemických sloučenin, jako jsou aminokyseliny a nukleové kyseliny, získávaných prostřednictvím potravy.
Bakterie přítomné v půdě a v kořenech luštěnin jsou schopny fixovat dusík cyklem, ve kterém dochází k toku hmoty a energie.
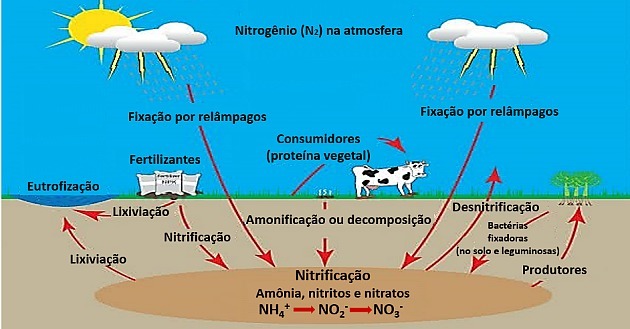
V prvním kroku dochází k biologické fixaci dusíku bakteriemi Rhizobiuma přeměnil ji na čpavek.
K fixaci dochází také fyzikálními jevy, jako je blesk, produkující malé množství amoniaku.
Při amonifikaci jsou odpady z metabolismu zvířat, jako je močovina, přeměňovány půdními bakteriemi na amoniak.
Nitrifikace transformuje amoniak na dusičnan ve dvou krocích:
Nejprve dochází k nitrosaci, kde dochází k bakteriím nitromonas oxiduje amoniak na dusitany.
Pak v nitracepůsobením bakterií Nitrobacter, dusitany se převádějí na dusičnany také oxidací.
Dusičnan je pak většinou rostlin asimilován.
Průmyslová odvětví proto přizpůsobila používání dusičnanů pro aplikace, jako jsou hnojiva.
Přebytek dusičnanů je transformován pseudonomas v plynném dusíku a v denitrifikačním kroku se vrací do atmosféry.
3. (Enem / 2017) Běžným faktem při vaření rýže je nalití části varné vody na modrý plamen ohně a její změna na žlutý plamen. Tato změna barvy může vést k různým interpretacím ve vztahu k látkám přítomným ve vodě na vaření. Kromě kuchyňské soli (NaCl) obsahuje sacharidy, bílkoviny a minerální soli.
Vědecky je známo, že tato změna barvy plamene nastává
a) reakce varného plynu se solí, těkavý plynný chlór.
b) emise fotonů sodíkem, excitovaná plamenem.
c) produkce žlutého derivátu reakcí se sacharidy.
d) reakce varného plynu s vodou za vzniku plynného vodíku.
e) excitace proteinových molekul s tvorbou žlutého světla.
Správná alternativa: b) emise fotonů sodíkem, excitovaná plamenem.
Když je sůl ve styku s vodou, dochází k iontové disociaci následovně:
Ionty sodíku a chloru jsou solvatovány molekulami vody.
Když se část vody na vaření rozlije, sodíkové ionty přijdou do styku s energií produkovanou v plameni a co se stane dále, vysvětluje atomový model Rutherford-Bohr:
Při přijímání energie jsou elektrony buzeny do vnější vrstvy, tj. Energičtější. Po návratu do méně energetického stavu dochází k uvolňování energie ve formě dobře definované barvy nebo elektromagnetického záření, fotonů.
Tento pohyb je znám jako kvantový skok, tj. Dochází k atomovému elektronickému přechodu.
Pro další otázky týkající se Chemistry on Enem jsme připravili tento seznam: Chemické otázky v Enem.
Quiz Enem: Science of Nature
Přečtěte si také o:
- Enemové otázky
- Simulovaný klystýr (otázky komentované odborníky)
- Humanitní vědy a jejich technologie
- Jazyky, kódy a jejich technologie
- Subjekty, které nejvíce spadají do Enem