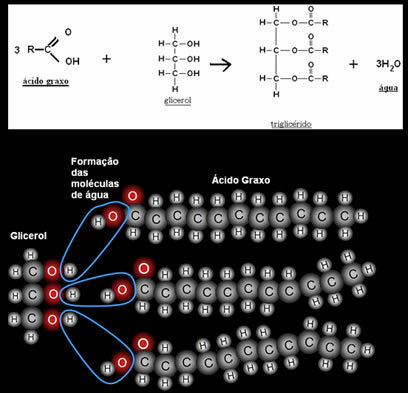
Soli jsou chemické látky tvořené iontovými vazbami mezi atomy. Funkce anorganické soli odpovídá iontovým sloučeninám, které mají alespoň jeden jiný kation než H+ a anion jiný než OH-.
Soli jsou přítomny v našem každodenním životě a jsou široce používány v potravinách a také v jiných oblastech. Oni jsou příklady solí:
- Chlorid sodný (NaCl): populárně známý jako kuchyňská sůl
- Uhličitan vápenatý (CaCO3): přítomný v kuličkách a vápenci
- Síran vápenatý (CaSO4): tvoří školní křídu a sádru
- Hydrogenuhličitan sodný (NaHCO3): používá se při vaření, medicíně a jako čisticí prostředek
Tyto látky obvykle vznikají při neutralizační reakci, kdy kyselina a báze reagují za vzniku soli a vody.
HCl(kyselina) + NaOH (základna) → NaCl(sůl) + H2Ó(Voda)
Při této reakci tvoří činidla kyselina chlorovodíková (HCl) a hydroxid sodný (NaOH) produkty chloridu sodného (NaCl) a vody (H2Ó).
V iontové vazbě dochází při přenosu elektronů mezi atomy a pro tento jeden z atomů musí být kov a druhý nekov. Díky tomu vznikají pozitivní chemické druhy, kationty, darováním elektronů a záporně nabitých aniontů, které je přijímaly.
Na obrázku níže pozorujte, jak vzniká chlorid sodný (NaCl).

Atom kovu sodíku (Na) daruje elektron atomu chloru (Cl). Tak se tvoří kation Na+, který se skládá z pozitivního iontu sodíku a aniontu Cl-, což odpovídá negativnímu iontu chloru.
vědět více o kyseliny a zásady.
Charakteristika solí
Je důležité si uvědomit, že ve vodném roztoku kyseliny vždy uvolňují H kation+ a báze uvolňují OH anion- (Arrheniova koncepce).
Soli však nemusí vždy mít stejný kation nebo anion, a proto nevykazují dobře definované funkční vlastnosti. Můžeme však říci, že obecně:
- Jsou to iontové sloučeniny (tvořené shluky iontů a ne molekulami);
- Mnoho z nich má charakteristickou slanou chuť (téměř vždy jedovatou);
- Jsou pevné a krystalické;
- Proveďte elektrický proud v roztoku;
- Tají a vaří se při vysokých teplotách;
- Rozpustný ve vodě (výjimky: některé sulfidy; chloridy, bromidy a jodidy s kationty Ag+, hg22+ a Pb2+, mezi ostatními).
Přečtěte si také o chemické funkce.
Klasifikace a nomenklatura solí
Podle způsobu, jakým probíhá reakce tvorby solí, se dělí na tři typy:
Neutrální nebo normální soli
Celková neutralizační reakce (všechny H reagují+ kyseliny a všech OH- základny). Tyto soli po rozpuštění ve vodě nemění pH.
Příklady:
NaOH (báze) + HCl (kyselina) → NaCl (normální sůl) + H2Ó
3NaOH (báze) + H3PRACH4 (kyselina) → Na3PRACH4 (normální sůl) + 3H2Ó
Název normálních solí: název soli pochází z názvu aniontu kyseliny, jehož zakončení _hydric nebo _oso nebo _ico bude nahrazeno příslušně: _etho ou_ito nebo _act a základní kation.
Sůl = (anionové jméno) + přípona etho / ito / jednatv (název kationtu).
Tím pádem:
- kyselina chlórhydr (HCl) + hydroxid sodík (NaOH) → chlórethosodík (NaCl) + voda
- kyselina dusičnankost(HNO2) + hydroxid z draslík(KOH) → dusičnanvelmi draslíku(KNO2) + voda
- kyselina ortofosforich (2h3PRACH4) + hydroxid z vápník(3Ca (OH)2 → ortofosfakt vápníku [Tady3(PRACH4)2] + voda (6H2Ó)
Kyselinové soli nebo vodíkové soli
Částečná neutralizační reakce s kyselinou (pokud ne všechny H+ kyseliny reaguje, takže sůl má ve své struktuře jeden nebo více ionizovatelných vodíků z kyseliny).
Příklad:
NaOH (báze) + H2POUZE4 (kyselina) → NaHSO4 (kyselá sůl) + H2Ó
Název kyselých solí: podobné jako normální soli, ale s uvedením počtu H+ podle předpon mono, di, tri, atd.
Sal = předpona čísla H+ + (anionové jméno) + přípona etho / ito / jednatv (název kationtu).
kyselina síraich (H2POUZE4) + hydroxid z sodík(NaOH) → monohydrogensíraaktv sodík (NaHSO4) + voda
kyselina ortofosforich (H3PRACH4) + hydroxid sodík(NaOH) → dihydrogen-ortofosfakt sodík (NaH2PRACH4) + voda
Zásadité nebo hydroxylové soli
Částečná bazická neutralizační reakce (Pokud ne reagují všechny hydroxylové skupiny, má sůl ve své struktuře jeden nebo více hydroxylových skupin).
Příklad:
Ca (OH)2 (báze) + HCl (kyselina) → Ca (OH) Cl (bazická sůl) + H2Ó
Název základních solí: podobné jako normální soli, ale s uvedením čísla OH- ve své struktuře.
Sal = předčíslí čísla OH- + (anionové jméno) + přípona etho / ito / jednatv (název kationtu).
kyselina chlórhydr (HCl) + hydroxid vápníku [Ca (OH)2] → monohydroxychlóretho vápníku [Ca (OH) Cl] + voda
kyselina chlórhydr (2HCI) + hydroxid hliník [Al (OH)3] → monohydroxychlórethov hliník [Al (OH) Cl2] + voda
Podvojné nebo smíšené soli
Reakce di, tri nebo tetrabázy s různými bázemi (podvojná sůl pro kation) nebo di, tri nebo tetrabázy s různými kyselinami (podvojná sůl pro anion).
Příklady:
Pokud jde o kation:
H2POUZE4 (dikyselina) + KOH (báze) + NaOH (báze) → KNaSO4 (dvojitý síran draselný a sodný) + 2H2Ó
H3PRACH4 (triacid) + 2KOH (báze) + NaOH (báze) → K.2NaPO4 (ortofosforečnan monosodný)
Pokud jde o anion:
Ca (OH)2 (dibase) + HBr (kyselina) + HCl (kyselina) → CaBrCl (chlorid-bromid vápenatý) + 2H2Ó
Al (OH)3 (tribase) + H2POUZE4(kyselina) + HCl (kyselina) → Al (SO4) Cl (chlorid hlinitý síran) + 3H2Ó
Znát hlavní anorganické funkce a nezapomeňte zkontrolovat otázky týkající se přijímací zkoušky na toto téma s komentovaným rozlišením v: cvičení anorganických funkcí.