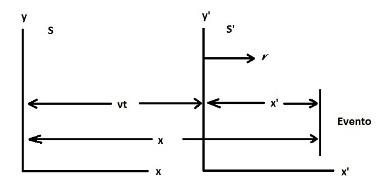
se definuje jako hybridizace spojení neúplných atomových orbitalů. Orbitál je klasifikován jako neúplný, pokud má pouze jeden elektron uvnitř toho místo dvou. Podívejte se na reprezentaci neúplného orbitálu a úplného orbitálu:

Na obrázku A máme úplnou oběžnou dráhu; v obraze B neúplná oběžná dráha.
Hybridizace je přirozený jev, ke kterému dochází u některých chemických prvků, jako je fosfor, síra, uhlík atd. Hybridizace uhlíku umožňuje atomům tohoto prvku, aby byly schopné vytvořit čtyři chemické vazby, tj. uhlík vytvoří čtyři vazby až poté, co podstoupí fenomén hybridizace.
Proč ale uhlík hybridizuje a vytváří čtyři vazby? Abychom porozuměli tomuto jevu, musíme znát elektronickou distribuci tohoto prvku:
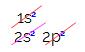
V elektronické distribuci uhlíku vidíme, že podúroveň 1s je úplná (se dvěma elektrony), 2s je kompletní (se dvěma elektrony) a podúroveň 2p je neúplná (podúroveň p podporuje šest elektronů, ale existuje pouze dva). Distribucí 2p elektronů reprezentativním způsobem musíme:
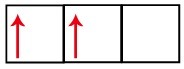
Podúroveň p má tři orbitaly - v případě uhlíku jsou dva z nich neúplné a jeden je prázdný. Z tohoto důvodu by tento prvek měl provádět pouze dva odkazy, protože počet neúplných orbitalů vždy určuje počet odkazů.
Při přijímání energie z vnějšího prostředí jsou však elektrony přítomné v uhlíku vzrušeny. Jeden z elektronů přítomných na podúrovni 2s se tedy přesune na oběžnou dráhu podúrovně p, která byla prázdná:
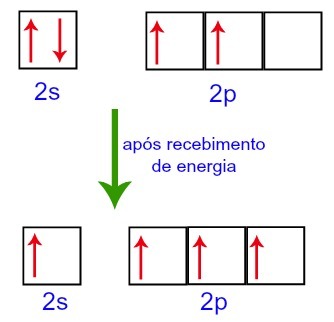
Uhlíkové orbitály před a po přijetí energie z vnějšího prostředí
Uhlíku tak na jeho druhé úrovni zbývají čtyři neúplné orbitaly. Potom se orbita podúrovně 2s spojí se třemi p orbitaly, což konfiguruje jev hybridizace.
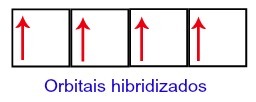
Uhlíkové orbitaly po hybridizaci
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm