Allotropy je jev, ke kterému dochází, když stejný chemický prvek má tu vlastnost, že tvoří více než jednu jednoduchou látku.. Tyto alotropické odrůdy se mohou lišit z důvodu počtu atomů prvku, které jsou navzájem spojeny v molekule, nebo z důvodu uspořádání atomů v krystalové mřížce.
Jedním z prvků, které mají alotropní odrůdy, je fosfor (P), nejběžnější je bílý fosfor to je červený fosfor. Tyto dva fosforové allotropy se neliší odlišným prostorovým uspořádáním, protože oba jsou v zásadě tvořeny čtyřboká molekulami, ale množství atomů fosforu je u každého odlišné.
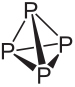
Podívejte se na složení a hlavní vlastnosti bílého a červeného fosforu:
- Bílý fosfor:
Molekulární vzorec bílého fosforu je P4, což znamená, že jeho molekuly jsou tvořeny čtyřmi atomy fosforu.

Tento typ fosforu je extrémně reaktivní, a to především díky napětí v úhlech 60 ° mezi jeho vazbami. Je tak reaktivní, že musí být skladován ve vodě, aby nedocházelo ke kontaktu se vzduchem a nevybuchlo. Při manipulaci s ním je třeba postupovat velmi opatrně, protože při požití způsobí těžké poleptání kůže a otravu (jen 0,1 g požitého bílého fosforu může vést k smrti).
Jak vidíte níže, bílý fosfor je bílá pevná látka podobná vosku.

Bílý fosfor uložený ve vodě, aby nedocházelo ke kontaktu se vzduchem *
Při zahřátí bez přítomnosti vzduchu se bílý fosfor změní na červený fosfor.
- červený fosfor:
Červený fosfor nemá stanovenou strukturu, ale existují důkazy o tom, že se jedná o makromolekuly vytvořené vazbou uvedených čtyřstěnných struktur (P4), zastoupená PNe.
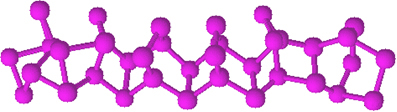
Je mnohem méně reaktivní než bílý fosfor, ale při tření se může vznítit. Proto se používá na bočních plochách zápalkových krabic. Když otřeme párátkem o povrch krabičky, zápalka se zapálí a zase zapálí vysoce hořlavý materiál na hlavě párátka.
V některých zemích je zápas umístěn na hlavě párátka ve tvaru P4s3.
Červený fosfor je amorfní prášek, to znamená, že nemá krystalickou strukturu a je tmavě červené barvy, jak je uvedeno níže:

Červený fosforový prášek.
* Autorství obrázků patří W. Oelen a ona se dá najít tady.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm

