Na organické eliminační reakce jsou ty, ve kterých jsou z ní odstraněny nebo odstraněny atomy nebo skupiny atomů molekuly, vytvoření nové organické sloučeniny, kromě anorganické sloučeniny, která je tvořena částí, která byla smazáno.
Jedním typem eliminační reakce je dehydratace, ve kterém je ztracenou molekulou voda. Dehydratace alkoholů (sloučeniny, které mají skupinu OH připojenou k nasycenému uhlíku v otevřeném řetězci) může probíhat dvěma způsoby: intramolekulární a intermolekulární.
„Intra“ znamená „uvnitř“, proto k intramolekulární dehydrataci alkoholů dochází, když dojde k výstupu molekuly vody z „vnitřku“ samotné molekuly alkoholu. V tomto případě bude organickým produktem alken.
Tato reakce probíhá pouze v přítomnosti katalyzátoru, který působí jako vysoušedlo, a většinou jde o koncentrovanou kyselinu sírovou (H2POUZE4) a teplota by měla být kolem 170 ° C.
Příklad:
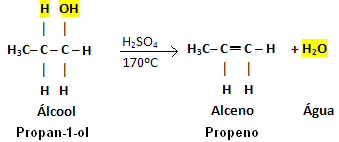
Všimněte si, že skupina OH odešla a vodík opustil sousední uhlík, což dalo vzniknout vodě. Dále byla vytvořena dvojná vazba, která dala vzniknout alkenu.
Zařízení trpící dehydratací následuje v následujícím sestupném pořadí:
Terciární alkoholy> Sekundární alkoholy> Primární alkoholy
Ale co když skupina OH přijde uprostřed uhlíkového řetězce? Atom vodíku, ze kterého se uvolní sousední atom uhlíku a vytvoří molekulu vody?
Nepřestávejte... Po reklamě je toho víc;)
Například další je 2-methylpentan-3-ol. Všimněte si, že jeden sousední atom uhlíku je terciární (zvýrazněn červeně), zatímco druhý je sekundární (zvýrazněn modře):
H OH H
│ │ │
H3C─ C ─ C ─ C CH3
│ │ │
H H CH3
Vodík navázaný na terciární atom uhlíku bude snazší opustit, protože jeho elektronegativní charakter je roven δ+1Čím menší je tedy povaha uhlíku, tím slabší je mezi nimi vazba a tím snadněji bude jejich vazba narušena.
V takových případech se vytvoří všechny možné sloučeniny, ale převaha bude uvedena v pořadí: Terciární alkoholy> Sekundární alkoholy> Primární alkoholy.
Takže máme:
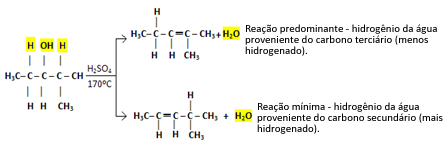
Tento typ reakce se řídí Saytzefovo pravidlo, který říká, že bude větší tendence vodíku zanechávat uhlík méně hydrogenovaný. Toto pravidlo je pravým opakem Markovnikovovo pravidlo používá se pro adiční reakce.
Chcete-li doplnit své znalosti o tomto předmětu, přečtěte si také text „Intermolekulární dehydratace alkoholů”.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Intramolekulární dehydratace alkoholů“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/desidratacao-intramolecular-dos-Alcoois.htm. Zpřístupněno 28. června 2021.