Vy Uhlovodíky jsou složeny tvořeny uhlík (C) a vodík (H). Pružnost uhlíku, který je hlavním prvkem těchto sloučenin, podporuje existenci obrovské rozmanitosti struktur Proto se některé vlastnosti, jako je teplota tání a teplota varu, mohou mezi jednotlivými uhlovodíky lišit.
Jsou to většinou molekuly nepolární, s sílas mezimolekulární typ indukovaného dipólu a hustota menší než The z vody. Identifikaci těchto sloučenin lze provést pomocí nomenklatury, která se řídí pravidly stanovenými Mezinárodní unií čisté a aplikované chemie (Iupac).
Přečtěte si také: Uhlík - jeden z nejhojnějších prvků ve vesmíru
Vlastnosti uhlovodíků

Polarita: uhlovodíky bez přítomnosti heteroatomů jsou nepolární.
Mezimolekulární síly: vazby mezi molekulami uhlovodíku jsou typu indukovaný dipól.
bod tání a avařící: se liší podle velikosti, funkce a strukturní organizace molekuly.
fyzický stav: za normálních podmínek teploty a tlaku jsou uhlovodíky se čtyřmi nebo méně atomy uhlíku v plynném stavu. Ti s 5 až 17 uhlíky jsou v kapalném stavu a uhlovodíky s více než 17 uhlíky jsou pevné látky.
Hustota: je menší než hustota vody, tj. méně než 1,0 g / cm³.
Reaktivita: alifatické a nenasycené uhlovodíky jsou špatně reaktivní; nenasycené sloučeniny častěji reagují s jinými molekulami a cyklické uhlovodíky s až pěti uhlíky jsou velmi reaktivní.
Nepřestávejte... Po reklamě je toho víc;)
Klasifikace uhlovodíků
Uhlovodíky lze klasifikovat strukturální organizací řetězce a zařízeními.Nenasycení je přítomnost dvojné nebo trojné vazby mezi uhlíky, je výskyt připojení typu pi (π). již větve jsou jako „větve“ připojené k větší uhlovodíkové struktuře. Cyklické řetězce mohou také obsahovat větve a / nebo nenasycení - strukturální organizace uhlovodíků s uzavřeným řetězcem tvoří polygony, jako jsou čtverce, trojúhelníky, hexan a další.
Pokud jde o uspořádání atomů, uhlovodík může mít normální nebo rozvětvený řetězec.
→ C uhlovodíknormální, lineární nebo přímka: ten s řetězcem, který má pouze dva konce.

→ C uhlovodíknenávidí rozvětvený: ten s řetězem, který má více než dva konce. Abyste věděli, kde a jaké jsou pobočky, je důležité správně vybrat hlavní řetězec. Hlavní řetězec musí obsahovat všechna nenasycení a heteroatomy (pokud existují), jakož i největší počet následných uhlíků. Uhlíky, které nejsou obsaženy v hlavním řetězci, jsou větve.
Příklad:

S ohledem na jeho „uzavření“ může mít uhlovodík uzavřený, otevřený nebo smíšený řetězec.
→ Řetězové uhlovodíkys uzavřené nebo cyklické: ty s řetězci, ve kterých se atomy samy organizují a vytvářejí cyklus, polygon nebo aromatický kruh (uzavřený uhlovodík se střídavým nenasycením). Pokud nemáte větev, nemějte volné konce. Každý vrchol polygonu představuje uhlík a jeho příslušné vodíkové vazebné látky.
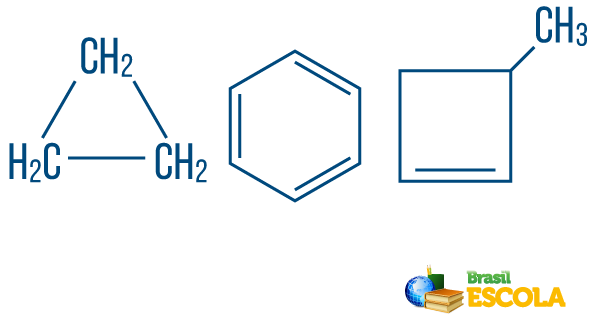
→ Otevřený řetězec nebo acyklické uhlovodíky: jsou ty s řetězy, které mají alespoň dva konce.

→ Uhlovodíky z řetězec smíšeného typu: je tvořen kruhem nebo cyklickým řetězcem připojeným k lineární části; má alespoň jeden konec.
Přečtěte si také: Aromatické uhlovodíky - příklady a vlastnosti
Nomenklatura uhlovodíků
Pro každý typ uhlovodíku existuje pravidlo pojmenování stanovené Iupacem. Názvosloví těchto sloučenin se provádí následovně:
1. část: umístění a název pobočky (pokud existují);
2. část: platí termín cyklus pokud je sloučeninou uzavřený řetězec, ale pokud jde o alifatický (otevřený) řetězec, nebude to nutné;
3. část: předpona označující, kolik uhlíků je v hlavním řetězci;
4. část: umístění a infix indikující typ nenasycení v molekule;
5. část: přípona „o“ vlastní uhlovodíkům.
Pokud má molekula otevřenou strukturu bez větvení, začíná nomenklatura v části 3.
Následující tabulka ukazuje požadované informace (předpona, přípona a přípona) pro názvosloví uhlovodíků obecně. Ó předpona liší se podle počtu uhlíků; Ó infix, podle počtu nenasycených; to je přípona“Ó" Výraz "uhlovodíkový typ" označuje sloučeniny uhlovodíkového typu.
Předpona |
Infix |
Přípona |
||
1 uhlík |
se setkal- |
Pouze jednotlivé hovory |
-an- |
-Ó |
2 uhlíky |
et- |
|||
3 uhlíky |
podpěra- |
1 dvojná vazba |
-en- |
|
4 uhlíky |
ale- |
|||
5 uhlíků |
pent- |
2 dvojné vazby |
-dien- |
|
6 uhlíků |
hex- |
|||
7 uhlíků |
hept- |
1 trojná vazba |
-v- |
|
8 uhlíků |
říjen |
|||
9 uhlíků |
ne- |
2 trojité odkazy |
-dino- |
|
10 uhlíků |
pro- |
Prvním krokem k objevení nomenklatury organické sloučeniny je identifikovat hlavní řetězec uhlíků, které musí obsahovat nenasycené mastné kyseliny a co nejvíce následných uhlíků. Po identifikaci hlavního řetězce se uhlíky musí být vyjmenovány - spuštění počítání ze strany nejblíže k větvím a nenasycením (pokud existují). THE lokalizace bude číslo uhlíku, kde se nachází větev nebo nenasycenost. Někdy existuje pouze jedno možné místo pro radikální nebo dvojnou nebo trojnou vazbu, takže není nutné v nomenklatuře vyjadřovat umístění spojovacího uhlíku.

THE nomenklatura pro pobočky bude dáno počtem uhlíků v každém plus ukončení čára nebo ll. Pokud existuje více než jedna větev, použije se abecední pořadí.
Viz příklady níže:
→ Příklad 1
CH3 - CH2 - CH3 → Propan
1. část: předpona “podpěra-”Znamená, že řetěz má tři uhlíky.
2. část: infix "-an-„Signalizuje, že molekula vytváří pouze spojení tohoto typu sigma nebo jednoduché.
3. část: přípona "-Ó„Je charakteristický pro uhlovodíky.
→ Příklad 2
CH2= CH-CH2-CH3 → But-1-en
U uhlovodíků s nenasyceností je nutné číslovat a lokalizovat uhlík, ve kterém se dvojice nachází, a číslování musí být co nejmenší. Počet uhlíků proto musí začínat stranou nejbližší dvojné vazbě.
1. část: "ale-" znamená, že v řetězci jsou čtyři uhlíky.
2. část: „1-cs“ Výraz "nenasycenost" označuje nenasycenost mezi 1 a 2 uhlíkem.
3. část: "-Ó" je charakteristická přípona uhlovodíků.
→ Příklad 3

1. část: „3-ethyl“ signalizuje, že na uhlíku 2 je větve se dvěma uhlíky.
2. část: „-pent-“ označuje přítomnost pěti uhlíků v hlavním řetězci.
3. část: „-an-“ je infix aplikovaný na nenasycené řetězce (žádné dvojné nebo trojné vazby).
4. část: "-Ó" je charakteristická přípona uhlovodíků.
→ Příklad 4
Pro řetězy s více než jedna pobočka, umístěte radikály v nomenklatuře v abecedním pořadí. Pokud jsou ve stejné molekule větve a nenasycení, měl by být počet uhlíků v hlavním řetězci proveden tak, aby součet číslic umístění byl co nejmenší.
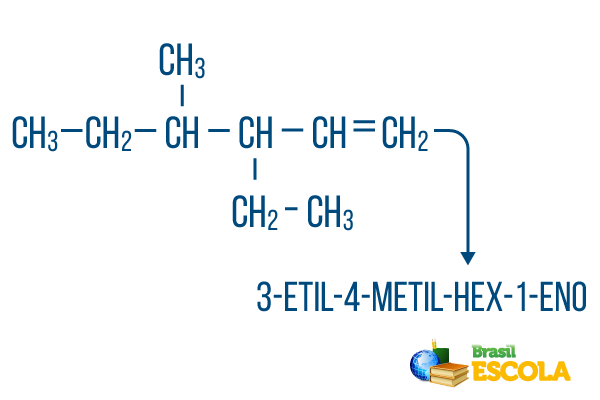
Počet uhlíků v hlavním řetězci byl proveden zleva doprava a součet čísel nenasycení a umístění větve je: 1 + 4 + 3 = 8. Pokud by počet uhlíků byl zprava doleva, složená nomenklatura by byla 4-ethyl-3-methyl-5-en, jehož součet míst by byl: 4 + 3 + 5 = 12, což je větší než u jiné hypotézy, takže by se neměl používat.
1. část: 3-ethyl-4-methyl odkazuje na radikály v abecedním pořadí a na jejich příslušných místech.
2. část: hex- znamená, že v hlavním řetězci je 6 uhlíků.
3. část: 1-en označuje přítomnost dvojné vazby na uhlíku 1.
4. část: "-Ó" je charakteristická přípona uhlovodíků.
→ Příklad 5
U uzavřených řetězců platí pravidla pojmenování, ale slovo cyklus začíná název sloučeniny, což naznačuje, že se jedná o uzavřený nebo cyklický uhlovodík.
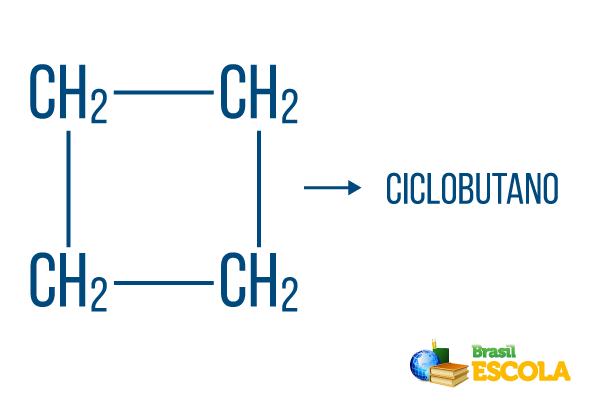
1. část: cyklus- označuje, že se jedná o uzavřený řetězec.
2. část: -ale- označuje existenci 4 uhlíků v řetězci
3. část: -Óje charakteristická přípona uhlovodíků.
Přečtěte si také: Klasifikace uhlíkových řetězců
Druhy uhlovodíků
Uhlovodíky lze rozdělit na alkany, alkeny, alkyny a alkadieny - které jsou klasifikovány jako podle založení řetězce (dvojné nebo trojné vazby) - a cyklány, které jsou řetězci Zavřeno.
→ Alkany: jsou uhlovodíky, které nemají nenasycenost. Obecný vzorec pro alkany je CNeH2n + 2a Nepředzvěst je složen z předpona + an + Ó.
Vy alkany lze nalézt v přírodě, jako plyn metan (CH4), který se uvolňuje zvířaty a vyrábí se v procesech rozkladu i v rafinériích a petrochemickém průmyslu. Sloučeniny jako propan (C3H7), butan (C4H10), který tvoří náš plyn na vaření (LPG), a oktan (C8H18), přítomné v pohonných hmotách, jsou vedlejšími produkty Ropa.

→ alkeny nebo alkeny: jsou uhlíkové řetězce, které mají nenasycenost, dvojnou vazbu. Jeho obecný vzorec je CNeH2na vaše Nepředzvěst je složen z Prefix + en + o.

Ó ethylenový plyn (C2H4), který se používá v zemědělství k urychlení dozrávání plodů, patří do funkce alken. Sloučenina se také používá při výrobě suroviny polyethylen, který se používá při výrobě plastového nádobí.
→ Alkyny nebo acetylenové: uhlovodíky s trojnou vazbou. Jeho obecný vzorec je CNeH2n - 2. THE nomenklatura je složen z prefix + in + o.

Ó acetylén nebo etin (C.2H2) je plyn alkynové funkce používaný v svary a kovové řezy. Tato směs může dosáhnout teploty až 3 000 ° C, což umožňuje provádět opravy na ponořených částech lodi.

→ alkadienes nebo dienes: uhlíkové řetězce se dvěma nenasycenými, tj. dvěma dvojnými vazbami mezi uhlíky. Obecný vzorec pro tuto funkci je C.NeH2n - 2. Uvědomte si, že je to stejný vzorec jako u alkynů, což znamená, že se to může stát izomerismus mezi sloučeninami (stejný molekulární vzorec pro různé sloučeniny).
Nomenklatura alkadienu se skládá z Prefix + dien + o.
Příklad:

→ Uhlovodíky s uzavřeným řetězcem: molekuly se organizují cyklickým způsobem, mají sklon tvořit mnohoúhelník a stejně jako v otevřených řetězcích mohou nastat usazeniny a / nebo důsledky. Cyklony, cykleny, cykliny a benzeny jsou uhlovodíky s uzavřeným řetězcem.
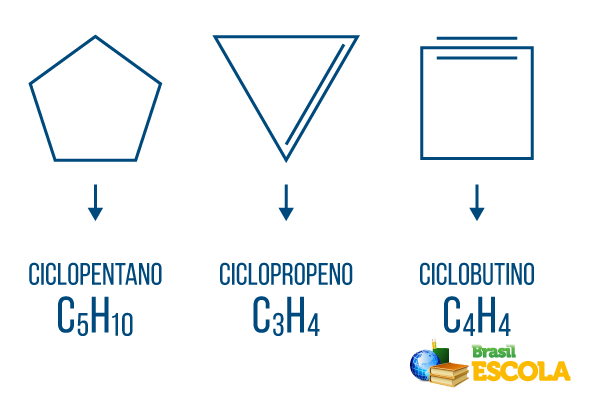
Cyklony nebo cykloalkany: cyklické řetězce skládající se pouze z jednoduchých vazeb. Jeho obecný vzorec je CNeH2n. Nomenklatura: ciclo + předpona + an + o.
Cykly nebo cykloalkeny: uzavřené uhlovodíkové řetězce s provozovnou. Jeho obecný vzorec je CNeH2n-2. Nomenklatura: Ciclo + předpona + en + Ó.
-
Cykliny nebo cykloalkyny: uzavřené řetězce uhlovodíků s přítomností dvou dvojných vazeb. Jeho obecný vzorec je CNeH2n-4. Nomenklatura: Ciclo + prefix + in + o.
benzeny
Benzen je typ uhlovodíku s uzavřeným řetězcem s šest uhlíků kde se vazby liší mezi jednoduchým a dvojitým. Tyto sloučeniny jsou toxický a vysoce karcinogenní, používá se jako organická rozpouštědla v chemických procesech.
Aby byl uhlovodík považován za aromatický, musí existovat alespoň jeden benzenový kruh, který je vysoce reaktivní, proto podléhá dvěma nebo více výměny, které zde uvidíme jako důsledky. Pokud existují dva spojovací radikály, budeme mít pro každou dvojici pozic konkrétní názvy.
Radiály na 1,2 uhlíku benzenu → ortho
Radikály na 1,3 uhlíku benzenu → fotbalová branka
Radiály na uhlíku 1,4 benzenu → pro
Annomenclatura aromatické sloučeniny se provádí následovně:
1. část: umístění ligandů (ortho, cíl nebo do).
2. část: název radikálu nebo radikálů připojených k benzenu (methyl, ethyl, propyl…). Název radikálů se řídí pravidly ostatních uhlovodíků.
- 3. část: -Bjed, což je charakteristický pojem pro aromatické uhlovodíky.
Příklady:
→ Ortho-dimethyl-benzen

1. část: Órto- označuje, že radikály jsou umístěny na uhlících 1 a 2.
2. část: -dimetyl- Termín "atom uhlíku" znamená dva radikály, oba s jedním atomem uhlíku.
3. část: -benzen je charakteristický výraz pro aromatické uhlovodíky.
→ Ortho-ethyl-methyl-benzen
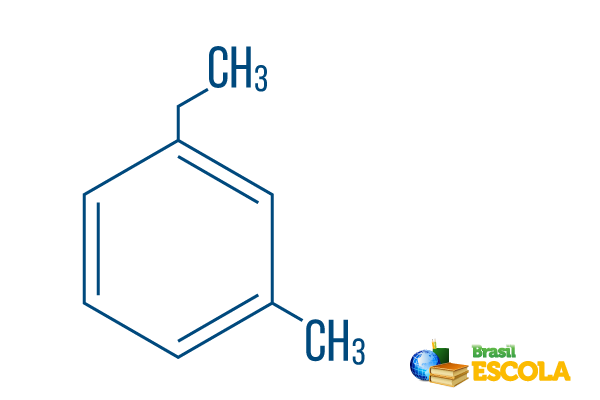
1. část: mAch- označuje, že radikály jsou umístěny na uhlících 1 a 3.
2. část: ethyl-methyl- "Množství uhlíku" znamená množství uhlíku v každém radikálu ethyl The dvouuhlíková větev a methyl větvení s jedním uhlíkem - umístěno v nomenklatuře v abecedním pořadí.
3. část: -benzen je charakteristický výraz pro aromatické uhlovodíky.
→ para-diethylbenzen
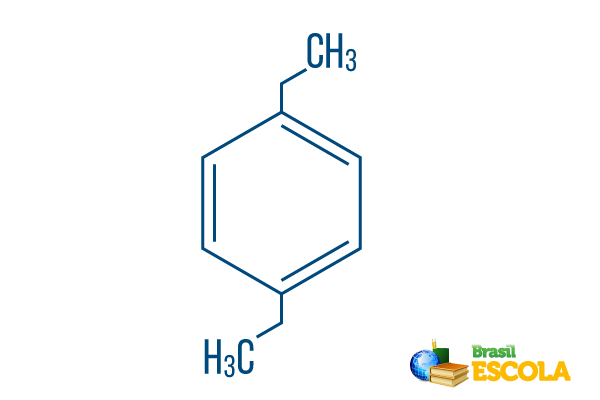
1. část: Ppluh- znamená, že radikály jsou na uhlících 1 a 4 benzenu.
2. část: -diethyl- odkazuje na dva radikály typu ethyl, to znamená dvě větve, každá se dvěma uhlíky.
3. část: -benzen je charakteristický výraz pro aromatické uhlovodíky.
Přečtěte si také:Objev struktury benzenu
vyřešená cvičení
(Unesp) - Oktan je jednou z hlavních složek benzínu, což je směs uhlovodíků. Molekulární vzorec oktanu je:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Odpověď: písmeno a). Analýza názvosloví sloučenin oktan, je to alkan, tj. molekula sestávající pouze z jednoduchých vazeb. Pokud je obecný vzorec pro alkany CNeH2n + 2, nahradíme-li „n“ osmičkou, což je množství uhlíků v hlavním řetězci - a v tomto případě jedinečné -, budeme mít molekulární vzorec oktanu C8H18.
(UFSCar-SP) - Zvažte následující tvrzení o uhlovodících.
I) Uhlovodíky jsou organické sloučeniny sestávající pouze z uhlíku a vodíku.
II) Alkenům se říká pouze nenasycené uhlovodíky s přímým řetězcem.
III) Cykloalkany jsou nasycené alifatické uhlovodíky obecného vzorce CnH2n.
IV) Jsou to aromatické uhlovodíky: brombenzen, p-nitrotoluen a naftalen.
Následující tvrzení jsou správná:
a) Pouze I a III.
b) Pouze I, III a IV.
c) Pouze II a III.
d) Pouze III a IV.
e) Pouze I, II a IV.
Odpověď: Písmeno a).
II - Alkeny jsou sloučeniny s dvojnou vazbou, to znamená nenasycené, ale mohou mít v řetězci důsledky, které nejsou výlučně lineární.
IV - Sloučeniny bromethobenzenu a p-nitrotoluenu patří k dalším organické funkce.
Laysa Bernardes
Učitel chemie