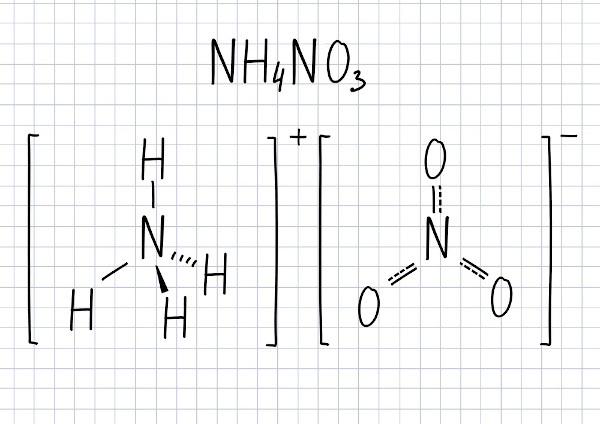
Ó dusičnan amonný je pevná látka molekulárního vzorce NH4NA3 a bílý vzhled (pokud je čistý). ustavený podle ionty NH4+ (amonný) a NO3- (dusičnan), není hořlavý, ale je vysoce oxidační a reaktivní. Jeho rozkladná reakce generuje jako produkt velké množství plynů, což z nevhodného skladování tohoto produktu dělá vážný problém, protože může dojít k výbuchu. A také široce používaný v zemědělství jako hnojivo.
Přečtěte si také: Přírodní látky - molekuly vzniklé z přírody
Co je dusičnan amonný?

Dusičnan amonný je to sůl tvořené NH ionty4+ (amonný) a NO3- (dusičnan). Je to pevná směs, která když čistý, má bílou barvu. Je široce používán jako zemědělské hnojivo, ale lze jej použít také při výrobě výbušnin, např je to velmi oxidující látka, poté oxiduje. Prchavá reakce dusičnanu amonného generuje vysoké uvolňování plynyzpůsobující explozivní náraz.
Nepřestávejte... Po reklamě je toho víc;)
Charakteristika dusičnanu amonného
Molární hmotnost: 80,04 336 g / mol.
Sůl složená z iontů: amonný (NH4+) a dusičnanů (č3-).
Vzhled: bílá pevná látka.
Je silně oxidující.
Snadno reaguje s jinými látkami.
Není hořlavý.
Pro normální teplotní a tlakové podmínky:
- hustota: 1,73 g / cm3;
- bod varu: 210 ° C;
- teplota tání: 169,6 ° C;
- stupeň rozpustnosti ve vodě: 216 g / 100 ml;
- pH: 5,5 (0,2 M).
Vzorec dusičnanu amonného
Molekulární vzorec této sloučeniny je NH4NA3.
Rozklad dusičnanu amonného
za to, že látka s vysokou reaktivitou a vysokým oxidačním potenciálem, pokud je dusičnan amonný vystaven vysoké teplotě, vyvolává a rozkladná reakce, a hlavními produkty jsou plyny, dusík, kyslík a vodní pára. Rozklad je uveden ve dvou krocích:
→ 1. krok:
2NH4NA3 (s) → 2N2O (g) + 4H2O (g)
→ 2. etapa:
2N2O → 2N2(g) + O.2(G)
→ Globální rovnice:
2NH4NA3 (s) → 2N2(g) + O.2(g) + 4H2O (g)
Všimněte si, že v první rovnicijeden z produktů získaný při rozkladu je oxid dusný (N2Ó), také známý jako rajský plyn. Používá se ke zvýšení výkonu automobilových motorů ke spalování paliva a jako anestetikum, zejména u zubních lékařů. Je to také jeden z hlavních plynů odpovědných za skleníkový efekt.
Podívejte se také: Jaké jsou typy chemických reakcí?
Výroba dusičnanu amonného
Dusičnan amonný lze získat reakce mezi síranem amonným (NH4)2POUZE4 a dusičnan vápenatý Ca (NO3)2. Viz. níže:
(NH4)2POUZE4 + Ca (č3)2 → 2 NH4NA3+ Případ4
Může být také vyroben z plynného amoniaku, který je probubláván v roztoku kyseliny dusičné a má jako reakční produkt vodný dusičnan amonný. Dívej se:
NH3 (g) + HNO3 (aq) → NH4NA3(tady)
Použití dusičnanu amonného

- Výroba hnojiv
- Výbušniny v dolech, lomech a stavebnictví
- Herbicidy a insekticidy
- Získávání oxidu dusného pro průmyslové aplikace
- Absorbenty pro oxidy
- Oxidant pro raketová paliva
- Výroba izotermických vaků
- Výroba anestetického kouře pro správu úlů ve včelařství
Také přístup: Jak bojovat s ohněm?
Nebezpečí dusičnanu amonného
Jedno z hlavních rizik spojených s dusičnanem amonným je nedostatečné skladování. Jelikož je to velmi oxidující látka a reaguje s několika dalšími sloučeninami, spouští a reakce s uvolněním velkého objemu plynu. Nesprávné skladování podléhá kontaminaci hořlavými produkty, vystavení teplu nebo zadržování plynů, co může způsobit výbuchy.
To se již stalo například v Texasu, ve Spojených státech, když nákladní loď pocházející z Francie přepravila 2 086 tun dusičnanu amonného. k nehodě došlo v roce 1947 a stal se známým jako Texas City Disaster. Tragédie způsobila smrt 581 lidí a došlo k němu kvůli požáru, který nebyl obsažen v lodi, která dosáhla amonného nákladu, což způsobilo výbuch.
Dalším příkladem byl sekvence výbuchu ke kterému došlo 4. srpna 2020 v přístavu město Bejrút, Libanon, zanechalo více než 100 mrtvých a 5 000 zraněných. Velikost exploze byla způsobena zapálením řetězové reakce nákladu tam uloženého 2 750 tun dusičnanu amonného.
Je také třeba poznamenat, že dusičnan amonný může způsobit podráždění kůže a očí a při vdechnutí dýchací problémy. V krevním řečišti má látka toxickou sílu, protože reaguje s tělesnými tekutinami a produkty této reakce, jako je dusičnan, mohou způsobit poškození zdraví, například modré dětské onemocnění, také známá jako infantilní methemoglobinemie (nízká hladina hemoglobinu v krvi). Toto onemocnění se v rodinách ve venkovských oblastech opakuje v důsledku kontaminace vodních útvarů v zemědělské oblasti dusičnanem amonným přítomným v hnojivech.
Laysa Bernardes
Učitel chemie
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
ARAúJO, Laysa Bernardes Marques de. "Dusičnan amonný"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/nitrato-de-amonio.htm. Zpřístupněno 27. června 2021.
Biologie
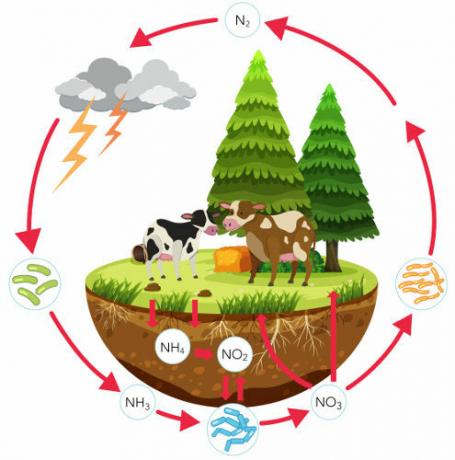
Zjistěte více o cyklu dusíku, důležitém biogeochemickém cyklu, který zajišťuje cirkulaci tohoto prvku. V tomto textu se budeme zabývat každým krokem cyklu dusíku, probereme jeho význam a zaměříme se na roli bakterií v tomto procesu. Představíme také cvičení na toto téma.