Roztok je homogenní směs dvou nebo více látek.. Jako například roztok soli (rozpuštěné látky) rozpuštěné ve vodě (rozpouštědlo).

Zejména v chemických laboratořích a průmyslových odvětvích je tento proces velmi důležitý, protože chemik potřebuje připravit roztoky se známými koncentracemi. Dále se při experimentálních činnostech používají roztoky s velmi nízkými koncentracemi, takže se vzorek koncentrovaného roztoku zředí na požadovanou koncentraci.
Denně, několikrát, aniž bychom si to uvědomovali, provádíme proces ředění roztoků. Například balení čisticích a hygienických výrobků, jako jsou dezinfekční prostředky, doporučuje, aby byly před použitím naředěny. Někteří výrobci navrhují na etiketách produktů, že se ředí vodou v poměru 1 až 3, to znamená, že pro každou část produktu je nutné přidat 3 díly vody. To se děje proto, že produkt je velmi koncentrovaný a silný a může poškodit místo, kde bude aplikován, pokud nebude správně naředěn. Na druhou stranu, pokud jej zředíte více, než by mělo, můžete přijít o peníze, protože produkt nedosáhne požadovaného výsledku.

Dalším příkladem je, když připravujeme džusy. Štítky mnoha koncentrátů šťávy označují, že sklenici džusu je třeba zředit nebo smíchat s 5 sklenicemi vody. Šťáva se tak stává „slabší“, tj. Méně koncentrovanou.
Nepřestávejte... Po reklamě je toho víc;)
Představte si, že jste takový džus zředili ve 3 litrech vody. Pokud byla počáteční koncentrace šťávy 40 g / l, znamená to, že měla hmotnost 40 g na každý litr rozpouštědla. Ale protože budeme mít 3 L, bude hmota vydělena 3 a koncentrace pak bude přibližně 13, 33 g / L, nebo 13 gramů na každý litr roztoku. V celém roztoku však hmotnost rozpuštěné látky 40 g stále zůstává.
Výpočet této nové koncentrace lze provést následovně:
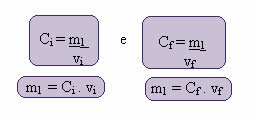
Kde indexy i a f představují počáteční a konečnou hodnotu. Protože se hodnota m1 nezměnila, můžeme rovnice vyrovnat:
Ci. protii = C.F. protiF
Nahrazení hodnot, které máme, podle předchozího příkladu, si všimněte:
Počáteční řešení:
Ci: 40 g / l
ml1: 40 g
protii: 1L
Konečné řešení:
CF: ?
ml1: 40 g
protiF: 3L
Ci. protii = C.F. protiF
(40 g / l). (1 L) = C.F. 3L
CF = 40 g / l
3
CF = 13,333 g / l
Stejná úvaha platí také pro molární koncentraci (M) a pro hmotnostní procento rozpuštěné látky nebo titru (T):
Mi. protii = M.F. protiF a Ti. protii = TF. protiF
Autor: Jennifer Fogaça
Vystudoval chemii
Tým brazilské školy
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Ředění roztoků“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. Přístup 27. června 2021.