Francouzský chemik Joseph Louis Proust (1754-1826) přistoupil k pečlivým experimentům týkajícím se množství složek určitých reakcí.
Například prvky, které tvoří vodu, jsou vodík a kyslík. Proust zjistil, že při této vodotvorné reakci vodík vždy reagoval s kyslíkem v konstantním a určitém poměru, který byl 1: 8. Podívejte se, jak se to stane níže:

Všimněte si toho bez ohledu na to, kolik masy použitých prvků bude podíl vždy stejný.
Proust poznamenal, že tomu tak nebylo jen u vody, ale u všech ostatních látek.
15,06 g sulfidu měďnatého (CuS) se vytvoří například reakcí 10,00 g kovové mědi (Cu) s 5,06 g síry (S). Pokud tedy zdvojnásobíme množství mědi (které se zvýší na 20,0 g) a pokud chceme, aby veškerá měď reagovala, bude rovněž nutné zdvojnásobit množství síry na 10,12 g při celkové tvorbě 30,12 g sulfid.
Nyní, pokud je přidána částka, která není v poměru, přebytečné množství zůstane, nebude reagovat. Toto si všimněte níže:
Nepřestávejte... Po reklamě je toho víc;)
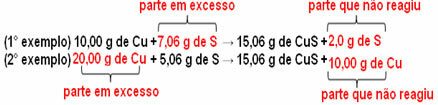
Všimněte si toho reakce probíhá pouze podle definovaného podílu
. V roce 1799 proto Proust dospěl k závěru, že když se několik látek spojí a vytvoří sloučeninu, vždy se to provede v definovaném hmotnostním vztahu.Takže vytvořil Zákon, který se nazývá Proustův zákon, Zákon stálých proporcí nebo Zákon o definovaných proporcích, který je uveden následovně:

Tento zákon a Lavoisierův zákon (Zákon o hromadné ochraně) jsou pojmenovány Zákony o hmotnosti, protože mluví v hromadě látek.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Proustův zákon nebo zákon stálých proporcí“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Zpřístupněno 27. června 2021.