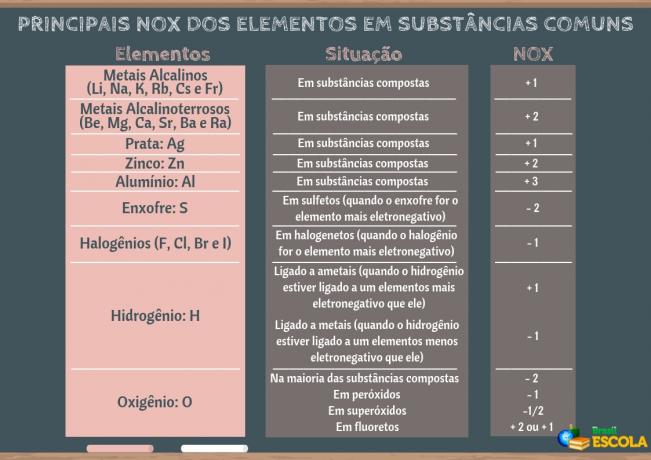
Ó chlorid sodný (stolní sůl) je sůl, kterou používáme v každodenním životě k solení ručně vyráběných nebo zpracovaných (průmyslových) potravin. Je to látka, která je také přítomna v různých přírodních potravinách, které denně konzumujeme, jako je ovoce, zelenina, luštěniny, semena atd.
V tomto textu budete vědět vše o této důležité látce pro každodenní život člověka:
definice
Chlorid sodný patří k anorganické funkci solí a je složen ze spojení kationu sodného (Na+) je to anion ctamoreto (Cl-) prostřednictvím a iontová vazba.
b) Chemické vlastnosti
Chlorid sodný je tvořen dvěma chemickými prvky:
→ Sodík (Na):
patří do rodiny kovů (schopných snadno tvořit kationty) alkalických (AI);
má elektron ve valenčním plášti;
má atomové číslo rovné 11;
má vysokou elektropozitivitu (schopnost ztrácet elektrony).
→ Chlor (Cl)
patří do rodiny halogenů (VIIA);
je to nekov (proto se tak snadno stává aniontem);
má ve valenčním plášti sedm elektronů;
má atomové číslo rovné 17;
má vysokou elektronegativitu (schopnost získávat elektrony).
Protože dva chemické prvky, které tvoří chlorid sodný, mají vysokou elektropozitivitu a vysokou elektronegativita, mezi nimi je iontová vazba (vytvořená mezi atomy s tendencí ztrácet a získávat elektrony).
Chemická struktura chloridu sodného se skládá z jediného aniontu chloridu (zelená koule), který interaguje se šesti sodnými kationty (modré koule), jak je vidět na níže uvedené struktuře:
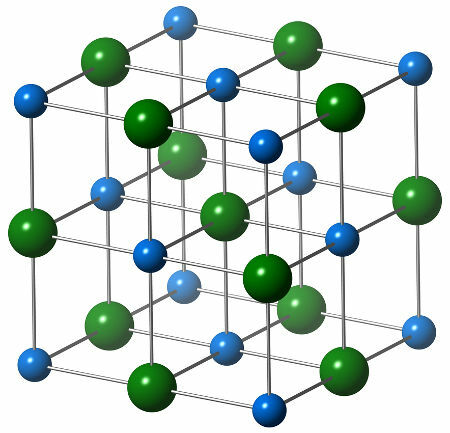
Reprezentace krystalové struktury chloridu sodného
c) Fyzikální vlastnosti
Bod fúze:
Chlorid sodný lze přeměnit z pevného stavu na kapalný při teplotě 801 ÓC.
Bod varu:
Chlorid sodný lze přeměnit z kapalného na plynný stav při teplotě 1465 ÓC.
Polarita
Jelikož se jedná o látku vzniklou iontovou vazbou, tj. Protože je to iontová sloučenina, je chlorid sodný polární.
Rozpustnost ve vodě
Můžeme rozpustit v 1 l vody, při 25 ° C ÓC, až 359 gramů chloridu sodného.
Rozpustnost v jiných rozpouštědlech:
Protože chlorid sodný je polární sloučenina, nelze jej rozpustit v žádném rozpouštědle nepolární povahy, jako je olej.
Hustota:
Hustota chloridu sodného je 2,165 g / ml, proto je hustší než voda, která má hustotu rovnou 1 g / ml.
Elektrická vodivost:
Jelikož se jedná o iontovou sloučeninu, je chlorid sodný schopen vést elektrický proud pouze tehdy, když:
-
Je v roztaveném stavu, tj. Kapalném;
Nepřestávejte... Po reklamě je toho víc;)
Rozpuštěno ve vodě.
d) Způsoby získání
Chlorid sodný lze získat fyzicky nebo chemicky:
1Ó) Získání fyzické:
frakční krystalizace
Chlorid sodný se získává odpařováním vody z oceánů.
podzemní doly
Je těžen v dolech pomocí těžební techniky.
podzemní ložiska
Extrahuje se z hlubinných ložisek rozpuštěním ve vodě (sůl přítomná v ložisku se rozpouští) a následným čerpáním.
2Ó) Získávání chemicky
syntéza reakce
Chlorid sodný lze získat chemickou reakcí syntézy (z jednoduchých látek vzniká sloučenina) mezi plynným chlorem a kovovým sodíkem:
2 palce(s) + Cl2 (g) → 2 NaCl(s)
Neutralizační reakce:
Dalším způsobem, jak chemicky získat chlorid sodný, je neutralizační reakce mezi kyselinou chlorovodíkovou a hydroxidem sodným, při které dochází k tvorbě soli a vody:
HCl(1) + NaOH(tady) → NaCl(tady) + H2Ó(1)
e) Důležitost pro člověka
Samotný chlorid sodný nemá v lidském těle žádnou funkci, ale když se disociuje na sodné kationty (Na+) a chloridové anionty (Cl-), každý z těchto dvou iontů má pro naše tělo několik důležitých funkcí. Podívejte se na některé z těchto funkcí:
→ Funkce kationu sodíku (Na+)
Zabraňuje srážení krve;
Bojuje proti tvorbě ledvin a žlučových kamenů;
Podílí se na regulaci tělesných tekutin;
Podílí se na regulaci krevního tlaku.
→ Funkce chloridového aniontu (Cl-)
Účast na tvorbě a tvorbě žaludeční šťávy (kyselina chlorovodíková - HCl);
Účast na tvorbě pankreatické šťávy.
f) Poškození lidského těla
Nadměrná konzumace chloridu sodného může způsobit následující poškození člověka:
→ Poškození způsobené nadbytkem sodných kationtů v těle:
Prodloužená doba hojení ran;
Zvýšený výskyt křeče;
Zvýšený krevní tlak;
Přetížení ledvin;
Zvýšená retence tekutin v těle.
→ Poškození způsobené nadbytkem chloridových aniontů v těle:
zničení vitamin E.;
Snížení produkce jódu v těle.
g) Další aplikace
Kromě použití k solení potravin lze chlorid sodný použít také v následujících situacích:
Výroba šamponů;
Výroba papíru;
Produkce Hydroxid sodný (NaOH);
Výroba detergentů;
Výroba mýdla;
Tání sněhu na místech, která trpí vánicemi;
Výroba kovového sodíku;
Výroba plynného chloru;
V izotonii pro náhradu tělesného elektrolytu;
V nosních dekongestivních řešeních;
Výroba solného roztoku; mimo jiné.
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Chlorid sodný (stolní sůl)“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Zpřístupněno 27. června 2021.
Iontové sloučeniny, hlavní charakteristiky iontových sloučenin, vazba mezi ionty, definitivní přenos elektronů, elektrostatické přitahovací síly mezi ionty, negativní a pozitivní ionty, anionty, kationty, iontová vazba, molekulární struktura on
Chemie

Iontová vazba, uspořádání mezi iontovými sloučeninami, iontovými aglomeráty, chloridem sodným, kuchyňskou solí, iontovou látkou, elektrostatické přitažlivé síly, chloridové anionty, sodné kationty, polární rozpouštědla, kladné ionty, kationty, záporné ionty, anionty.