baterie je to systém, ve kterém se chemická energie spontánně transformuje na energii elektrickou.
V roce 1836 anglický chemik a meteorolog John Frederic Daniell (1790-1845) postavil hromadu odlišnou od té v té době známé: hromadu Alessandra Volty. V této hromadě on propojené dvě elektrody, což byly systémy sestávající z kovu ponořeného do vodného roztoku soli tvořené kationty tohoto kovu.
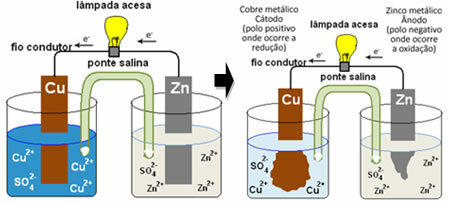
Jedna z elektrod, měděná elektroda, sestávala z měděné desky namočené v roztoku síranu měďnatého (CuSO4). Druhou elektrodou byla zinková elektroda, sestávající ze zinkové desky ponořené do roztoku síranu zinečnatého (ZnSO4).
Tyto dvě elektrody byly vzájemně propojeny elektrickým obvodem, který obsahoval lampu, protože pokud by se rozsvítila, znamenalo by to vznik elektrického proudu.
Mezi nimi byl také solný most. Tento můstek sestával ze skleněné trubice ve tvaru písmene U obsahující koncentrovaný vodný roztok vysoce rozpustné soli, jako je například chlorid draselný (KCl (vodný)). Konce tuby jsou potaženy bavlnou nebo agarem.
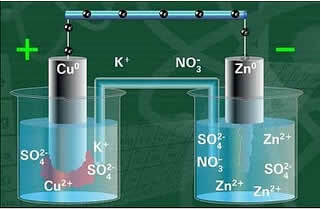
Níže máme strukturu tohoto článku nebo elektrochemického článku, který se stal známým jako Daniellův článek. Pamatujte, že každá elektroda se nazývá půlčlánek.
Když je obvod uzavřen, lampa se rozsvítí a po nějaké době zinková deska je zkorodovaná a má sníženou hmotnost, zatímco měděná deska je opačná, její hmotnost se zvyšuje (jak ukazuje obrázek níže). Rovněž je třeba poznamenat, že dochází ke zvýšení koncentrace iontů Zn v mol / L2+ a pokles iontů Cu2+.
Daniell's Stack Schematic.
Proč se tohle děje?
Nepřestávejte... Po reklamě je toho víc;)
Abychom to pochopili, podívejme se na reakce, které probíhají na každé elektrodě samostatně.
V zinkové elektrodě dochází k následující rovnovážné reakci:
Zn (s) ↔ Zn2+(tady) + 2 a-
To znamená, že kovový zinek (z desky) podléhá oxidaci, to znamená, že daruje dva elektrony kationu zinku (z roztoku) a stává se Zn2 +. Dochází také k opaku, kation zinku přítomný v roztoku přijímá dva elektrony darované zinkem a stává se kovovým zinkem. Proto existuje nepřerušovaný proces oxidace a redukce.
Totéž platí pro měděnou elektrodu, která bude mít globální reakci v dynamické rovnováze: Cu (s) ↔ Cu2+(tady) + 2 a-
Daniell si uvědomil, že kdyby spojil tyto dvě elektrody, reaktivnější by daroval své elektrony méně reaktivnímu kationtu, místo aby to dělal s kationty ve svém vlastním řešení. V tomto případě je zinek nejreaktivnější a podléhá oxidaci, přičemž elektrony daruje mědi, a proto klesá její hmotnost. Elektroda, která prochází oxidací, je záporný pól, nazývaný anoda. Měděná elektroda je ta, která prochází redukcí, kation mědi přijímá dva elektrony ze zinku a nazývá se katoda (kladný pól).
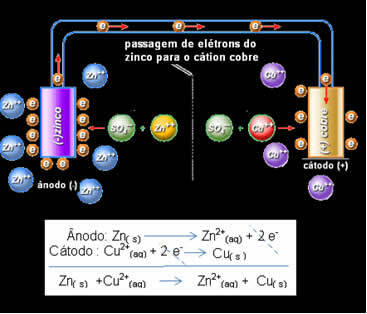
Průchod elektronů a Daniellův zásobník globální rovnice.
Nahoře máme globální rovnici pro tento zásobník, která se získá sečtením dvou polovičních reakcí. Jeho reprezentace nebo chemická notace se provádí podle následujícího pravidla:

Takže pro Daniellův stack máme:
Zn / Zn2+// Ass2+ / zadek
Autor: Jennifer Fogaça
Vystudoval chemii
Tým brazilské školy
Fyzikálně-chemické - Chemie - Brazilská škola
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Danillova hromada“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Zpřístupněno 28. června 2021.