Každý článek je zařízení, ve kterém dochází k spontánní oxidačně-redukční reakci, při které se generuje elektrický proud, který se zase používá k tomu, aby některé zařízení fungovalo.
Tato zařízení dostala své jméno, protože první baterii, která má být vytvořena, vynalezl Alessandro V roce 1800 ji tvořili zinkové a měděné disky oddělené bavlnou nasáklou dovnitř solanka. Tato sada byla umístěna střídavě, jedna na druhou, hromadí disky a tvoří velký sloup. Jak bylo baterie disků, začal být nazýván tímto jménem.

Baterie jsou vždy složeny ze dvou elektrod a elektrolytu. Kladná elektroda se nazývá a katoda a to je místo, kde reakce snížení. Záporná elektroda je anoda a to je místo, kde reakce oxidace. Také se nazývá elektrolyt solný most a je iontově vodivé řešení.
Abyste pochopili, jak to generuje elektrický proud, podívejte se na případ jedné z prvních baterií, na Daniellina hromada, ve kterém byla nádoba s roztokem síranu měďnatého (CuSO4 (aq)) a ponořený do tohoto roztoku byl měděnou deskou. V další samostatné nádobě byl roztok síranu zinečnatého (ZnSO
4 (aq)) a máčenou zinkovou desku. Oba roztoky byly spojeny solným můstkem, kterým byla skleněná trubice s roztokem síranu draselného (K.2POUZE4 (aq)) se skleněnou vlnou na koncích. Nakonec byly obě desky vzájemně propojeny vnějším obvodem s lampou, jejíž osvětlení by naznačovalo průchod elektrického proudu: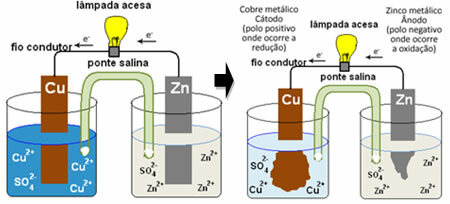
Dochází k tomu, že zinek má větší tendenci k oxidaci, tedy ke ztrátě elektronů, takže kovový zinek čepele funguje jako záporná elektroda, anoda, kde dochází k oxidaci: Zn(s) ↔ Zn2+(tady) + 2 a-. Elektrony ztracené zinkem jsou transportovány vnějším obvodem na měď a vytvářejí elektrický proud, který zapíná lampu. Ionty mědi v roztoku přijímají elektrony (redukují) a transformují se na kovovou měď, která se ukládá na měděném plechu. To znamená, že se jedná o kladnou elektrodu, katodu, kde dochází k redukci: Osel2+(tady) + 2 a- ↔ zadek(s).
Nepřestávejte... Po reklamě je toho víc;)
Dnešní baterie mají stejný pracovní princip, při kterém jeden kov prostřednictvím elektronového dárce daruje elektrony druhému a vyrábí se elektrický proud. Rozdíl je v tom, že dnes používané baterie jsou suché, protože nepoužívají kapalný roztok jako elektrolyt, jak se vyskytuje v Daniellině baterii.
Dnes je komerčně prodáváno velmi široké spektrum baterií. Mezi nejběžnější patří kyselé buňky (z Leclanché) aalkalické baterie.
Oba mají zinek jako zápornou elektrodu; na druhé straně je jako kladný pól ve středu hromady instalována grafitová tyč obklopená oxidem manganičitým (MnO2), práškové uhlí (C) a vlhká pasta. Rozdíl je v tom, že v kyselé hromadě se ve vlhké pastě používá chlorid amonný (NH).4Cl) a chlorid zinečnatý (ZnCl2) - soli kyselého charakteru - kromě vody (H2Ó). V alkalické baterii se používá hydroxid draselný (KOH), což je báze.

Baterie Leclanché jsou nejvhodnější pro zařízení vyžadující lehké a trvalé vybití, jako jsou dálkové ovládání, nástěnné hodiny, přenosné rádio a hračky. Alkalické baterie mají naproti tomu o 50 až 100% více energie než běžná baterie stejné velikosti, což se doporučuje u zařízení, která vyžadují rychlejší a intenzivnější stahování, jako jsou rádia, přehrávače CD / DVD, přenosné přehrávače MP3, baterky, digitální fotoaparáty atd.

Zjistěte více o tom, jaké elektrolyty a elektrody se používají v těchto i jiných typech baterií. pokud jde o to, jaké typy zařízení jsou nejvíce doporučeny, přečtěte si další související články níže.
Autor: Jennifer Fogaça
Vystudoval chemii


