Některé sloučeniny mají ve své struktuře dvojné vazby střídající se s jednoduchými vazbami. Nejznámějším ze všech je benzen, jehož strukturu navrhl v roce 1865 německý chemik Friedrich August Kekulé (1829-1896). Jeho struktura by byla cyklická a tvořena třemi dvojnými vazbami rozptýlenými třemi jednoduchými vazbami, jak je znázorněno na obrázcích níže:
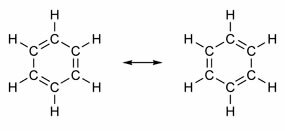
Oba způsoby reprezentace benzenu jsou přijatelné, protože je možné měnit elektrony vazeb π beze změny polohy atomů. Ani jeden však nepředstavuje přesně to, čím je, ani nevysvětluje své chování. Měl by se chovat jako alken a vyvolat adiční reakce, ale v praxi se to neděje. Benzen je docela stabilní a chová se, jako by neměl dvojné vazby; dává substituční reakce jako u alkanů.
V roce 1930 americký vědec Linus Pauling navrhl rezonanční teorii, která vysvětlila tento zjevný rozpor. Tato teorie říká:
Nepřestávejte... Po reklamě je toho víc;)
"Kdykoli můžeme ve strukturním vzorci změnit polohu elektronů." beze změny polohy atomůskutečná struktura Ne nebude žádná ze získaných struktur, ale spíše a rezonanční hybrid těchto struktur. “
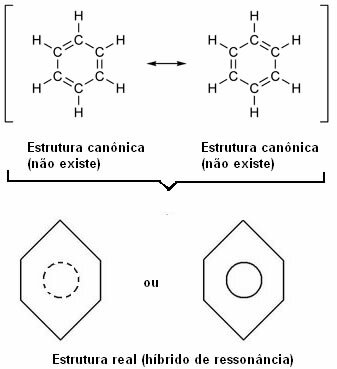
O tomto efektu svědčí velikost uhlíkových vazeb a vzdálenost mezi nimi. Tato vzdálenost je střední od vzdálenosti jednoduché vazby (1,54 Á) a vzdálenosti dvojné vazby (1,34 Á); je tedy 1,39 Å, kvůli rezonančnímu efektu.
Tento účinek lze také pozorovat ve struktuře molekuly ozonu (O3), Jak je ukázáno níže:
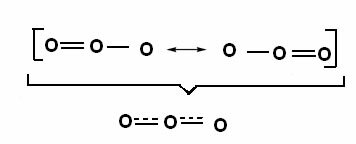
Kanonické struktury a hybridy rezonance ozonu.
Autor: Jennifer Fogaça
Vystudoval chemii
Tým brazilské školy.
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Rezonance v chemických sloučeninách“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm. Zpřístupněno 28. června 2021.