Oxidace energie v alkyny je organická reakce, ke které dochází, když se k kyselému roztoku přidá alkyn (uhlovodík, který má trojnou vazbu mezi dvěma uhlíky) činidlo z baeyer (Manganistan draselný - KMnO4).
POZNÁMKA: Reakce oxidace energie lze provést s dichromanem draselným (K.2Cr2Ó7), a to nejen manganistan draselný.
Kdykoli reakce od provádí se energetická oxidace v alkynech, produkty, které mohou vznikat, jsou karboxylové kyseliny, voda (jediná položka, která se objevuje v každém z nich) a oxid uhličitý (CO2).
Baeyerovo činidlo v kyselém prostředí
Když je Baeyerovo činidlo smícháno s vodou, v přítomnosti a kyselina (látka schopná uvolňovat ionty H+), vznik dvou oxidy (oxid draselný a oxid manganatý II) a rodící se kyslíky ([O]).

Mechanismy oxidace energie v alkynech
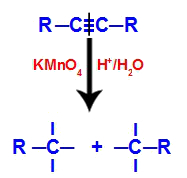
1. mechanismus: rozbití trojné vazby.
Zpočátku je trojná vazba napadena rodícími se kyslíky vytvořenými Baeyerovým činidlem. Tento útok způsobí úplné rozbití trojné vazby.
Narušení trojné vazby útokem rodících se kyslíků
Když se trojná vazba rozbije, alkyn se rozdělí na dvě části. Na každém z uhlíků, které byly trojné, se objevily tři volné valence.
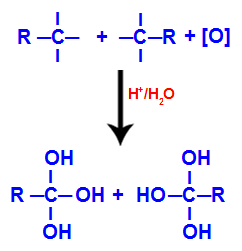
2. mechanismus: Interakce hydroxylových skupin
Každá z volných valencí na uhlících, kde byla trojná vazba, je obsazena hydroxylovými skupinami (OH), tvořící polyol (alkohol s několika hydroxyly).
Tvorba polyolu s hydroxylovými skupinami po štěpení trojnou vazbou
POZNÁMKA: Pokud má uhlík, kde byla trojná vazba, vázán atom vodíku, dostane tento atom vodíku rodící se kyslík a také vytvoří další hydroxylovou skupinu.
3. mechanismus: Tvorba molekul vody
Pokud má uhlík dvě nebo více skupin OH, stává se velmi nestabilní strukturou díky extrémně přítomnému uhlíku elektronegativa. Kvůli nestabilitě tedy molekula podléhá samodehydrataci, to znamená, že se hydroxylová skupina váže na hydronium (H+) z jiného hydroxylu a tvoří vodu.

Tvorba molekul vody ze dvou hydroxylových skupin přítomných ve vytvořeném polyolu
Nepřestávejte... Po reklamě je toho víc;)
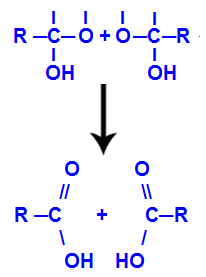
4. mechanismus: Tvorba produktu
Po vytvoření molekul vody ztratí uhlík vazbu v důsledku výstupu a hydroxyl a kyslík druhého hydroxylu také ztrácí vazbu, která byla vytvořena s vodík. Proto se mezi tímto uhlíkem a kyslíkem objevuje dvojná vazba, která tvoří karbonylovou skupinu (C = O) a stabilizuje obě.
Tvorba karbonylu ve dvou strukturách získaných z alkynu
Příklad rovnice oxidace energie v alkynech
Příklad: Energetická oxidace But-1-ino
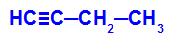
Strukturní vzorec but-1-yne
Když se but-1-in umístí do média, které obsahuje Bayerovo činidlo, vodu a kyselinu, vazba se rozbije. trojnásobek mezi uhlíky 1 a 2, v důsledku útoku rodících se kyslíků existujících uprostřed, jako v rovnici níže:
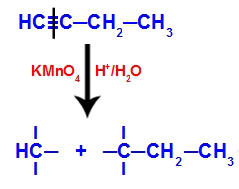
Rozbití but-1-yonových vazeb
Po rozbití trojné vazby uhlíky 1 a 2 obdrží tři hydroxyly, ale uhlík 1 bude mít ještě jednu, protože měl atom vodíku (který se váže na rodící se kyslík) a tvořil dva polyoly (fragment 1 a 2).

Rovnice představující tvorbu polyolů
Brzy poté, co jsou polyoly nestabilní, dochází k tvorbě molekul vody z hydroxylových skupin. Ve fragmentu 1 se objevuje molekula vody (protože jsou tam tři hydroxyly) a ve fragmentu 2 se objevují dvě molekuly (protože jsou tam čtyři hydroxyly).
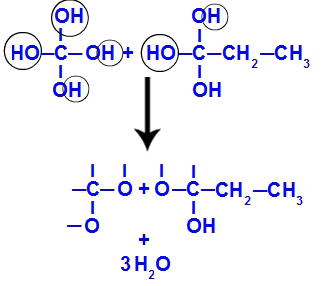
Tvorba molekul vody z fragmentů but-1-ynu
A konečně máme dvojnou vazbu mezi uhlíky, které ztratily hydroxylovou skupinu, a kyslíky, které ztratily vodík, což vede ke vzniku karbonylových skupin.

Tvorba karbonylů ve fragmentech but-1-inu
S výše uvedenou rovnicí vidíme, že but-1-yn způsobil vznik karboxylové kyseliny a oxidu uhličitého (CO2).
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Oxidace energie v alkynech“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm. Zpřístupněno 28. června 2021.
Alkyny, etické uhlovodíky, acetylenové uhlovodíky, acyklický uhlíkový řetězec, uhlíkový řetězec homogenní, nenasycený uhlíkový řetězec, trojná vazba, PVC, PVA, acetylen, syntetické kaučuky, plasty, dráty textil.