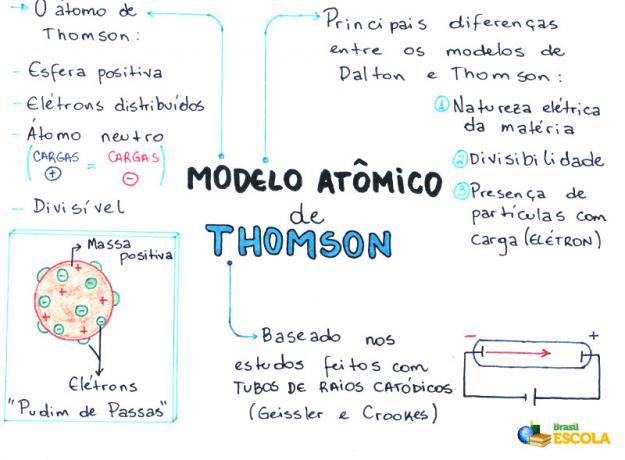
Ó Thomsonův atomový model byl navržen v roce 1898 anglickým fyzikem Josephem Johnem Thomsonem nebo jednoduše J. J. Thomsonem. Po několika experimentální důkazy o existenci elektronu, převrátil teorii nedělitelnosti atomu navrženou John Dalton.
Thomson na základě svého modelu potvrdil a prokázal existenci elektrony (částice se záporným elektrickým nábojem) v atomu, to znamená, že atom má subatomární částice.
Myšlenková mapa: Thomsonův atomový model
* Chcete-li stáhnout myšlenkovou mapu v PDF, Klikněte zde!
Thomson navrhl svůj atomový model na základě objevů souvisejících s radioaktivitou a experimentů prováděných s katodovou trubicí vytvořenou vědci Geissler a Crookes. Podívejte se na vyobrazení této trubky:
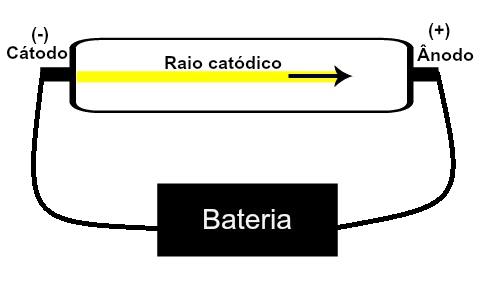
Pokud je nízkotlaký plyn ve zředěném stavu vystaven vysokému elektrickému napětí (např. 15 000 V), produkuje a paprsek světla (složený z elektrických nábojů) z katody (záporný pól) směrem k anodě (pól pozitivní).
S tímto experimentem dospěl Thomson k závěru, že když atomy plynného materiálu uvnitř trubice byly vystaveny vysokému napětí, jejich elektrony byly vytrženy a směrovány na desku pozitivní.
Úvahy navržené atomovým modelem Thomson
S experimenty prováděnými s katodovou trubicí navrhl Thomson svou interpretaci toho, jaký bude atom a jeho složení. Takže podle něj:
- Atom je koule, ale ne masivní, jak navrhuje Atomový model Johna Daltona;
- Atom je neutrální, protože veškerá hmota je neutrální;
- Protože atom má elektrony, které mají záporné náboje, musí mít kladné částice, aby konečný náboj byl nulový;
- Elektrony nejsou fixovány nebo zachyceny v atomu, mohou být za určitých podmínek přeneseny na jiný atom;
- Atom lze považovat za spojitou tekutinu s kladnými náboji, kde by byly distribuovány elektrony, které mají záporný náboj;
- přidružené vaše model na rozinky pudink (které představují elektrony);
- Protože elektrony, které jsou rozptýleny, mají stejný náboj, dochází mezi nimi k vzájemnému odpuzování, což je činí rovnoměrně rozloženými ve sféře.
Novinky navrhované atomu Thomsonovým modelem
Thomsonův atomový model byl druhým navrženým pro atom. První model formuloval John Dalton.
Nepřestávejte... Po reklamě je toho víc;)
Thomsonův model se zabýval novými poznatky o atomu, které do té doby nebyly navrženy kvůli nedostatku vědeckých základů, jako například:
- Elektrická podstata hmoty;
- Rozštěpitelnost atomů;
- Přítomnost malých nabitých částic v atomu.
Problémy poukazovaly na atom Thomson
Několik fyziků v době návrhu Thomsonův atomový model, na základě teorií klasické fyziky, poukázal na některé nesrovnalosti přítomné v tomto modelu:
- Thomson navrhl, aby atom měl stabilitu ve vztahu k rovnoměrnému rozložení elektronů, kterou lze upravit vlivem energie. Klasická fyzika však vychází z elektromagnetismus, neumožňuje existenci stabilního systému založeného pouze na odpuzování mezi částicemi stejného náboje;
- U Thomsona jsou elektrony rovnoměrně rozloženy v atomu, ale mají schopnost zrychleným způsobem, a proto musí při určitých frekvencích vyzařovat elektromagnetické záření charakteristický. To však nebylo pozorováno.
- Thomsonův model byl často neúčinný při vysvětlování atomových vlastností, jako je jejich složení a organizace.
* Mind Map od Victora Ricarda Ferreiry
Učitel chemie
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Thomsonův atomový model“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Zpřístupněno 27. června 2021.
Chemie

Niels Bohr, Bohrův atom, atomová fyzika, stabilní atom, atomový model, planetární systém, vrstvy elektrosféry, energetické hladiny, elektronové skořápky, elektronová energie, Rutherfordův atomový model, atom excitovaného stavu.
Chemie

Atomy a konstrukce vesmíru, atomová teorie, že všechno je stvořeno, hmota je tvořena atomy, teorie čtyř prvků, starověcí alchymisté, atomová teorie, základní částice.