Hodnota pH odpovídá vodíkovému potenciálu roztoku. Je určena koncentrací vodíkových iontů (H+) a slouží k měření stupně kyselosti, neutrality nebo zásaditosti daného roztoku.
Kromě pH existuje také další množství, které určuje kyselost a zásaditost vodného systému: pOH (hydroxyliontový potenciál). Tato stupnice má stejnou funkci jako pH, i když je méně používaná.
pH stupnice
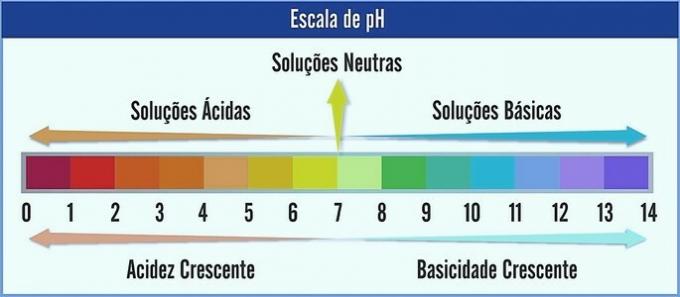
PH je znázorněno na stupnici od 0 do 14. Měří kyselost a zásaditost roztoku.
Proto pH 7 představuje neutrální roztok (např. Čistá voda). Ty, které jsou před ním, jsou považovány za kyselé roztoky (kyselé pH) a ty po 7 jsou bazické roztoky (alkalické pH).
S tímto pozorováním se kyselý charakter zvyšuje zprava doleva. Základní znak zleva doprava. Upozorňujeme, že čím nižší je hodnota pH, tím bude roztok kyselější.
Více se dozvíte na:
- Pufrovací roztok
- Titrace
- Neutralizační reakce
Příklady
Kyselinová řešení
| Řešení | pH |
|---|---|
| Žaludeční šťávy | 2,0 |
| Citronová šťáva | 2,2 |
| Ocet | 3,0 |
| Káva | 5,0 |
| Kravské mléko | 6,4 |
Základní řešení
| Řešení | pH |
|---|---|
| lidská krev | 7,35 |
| Mořská voda | 7,4 |
| Hydrogenuhličitan sodný | 8,4 |
| Magnéziové mléko | 10,5 |
| Bělidlo | 12,5 |
Jak vypočítat pH?
V roce 1909 navrhl dánský chemik Soren Sörensen (1868-1939), že kyselost roztoků, měřená jako koncentrace iontů H+, nechal své hodnoty transformovat pomocí logaritmů, aby usnadnil porozumění.
Při teplotě 25 ° C je iontový produkt vody roven 10–14 mol2/ L.2.
Použitím cologaritmu ve výrazu musíme:
Prostřednictvím tohoto výrazu můžeme získat odpovídající hodnotu z jedné stupnice na druhou pomocí odčítání.
Jak měřit pH?
Kontrola pH je důležitá nejen pro vědecké účely, ale také v každodenním životě.
Je třeba zkontrolovat pH bazénu, stejně jako pH akvária a dokonce i pH půdy, aby bylo možné u určitých druhů plodin.
Níže jsou uvedeny hlavní způsoby měření pH.
acidobazický indikátor
K měření pH roztoku se používají takzvané acidobazické indikátory. Jsou to látky, které mění barvu, což naznačuje charakter roztoku. Nejpoužívanějšími indikátory jsou: lakmus a fenolftalein.

Krokoměr
Kromě indikátorů lze pH roztoku měřit pomocí přístroje zvaného Peagometr. Toto elektronické zařízení měří elektrickou vodivost roztoku a převádí ji na stupnici hodnot pH.

Cvičení na přijímací zkoušky se zpětnou vazbou
1. (Enem / 2014) Výzkumník si uvědomuje, že štítek jedné ze sklenic, ve kterých uchovává koncentrát trávicích enzymů, je nečitelný. Neví, který enzym sklo obsahuje, ale má podezření, že jde o žaludeční proteázu, která pracuje v žaludku trávením bílkovin.
Věděl, že trávení v žaludku je kyselé a střevo je základní, sestavil pět zkumavek s jídlem odlišně, přidejte enzymový koncentrát do roztoků se stanoveným pH a počkejte, až bude enzym v nějakém působit jejich.
Zkumavka, ve které musí enzym působit, aby naznačila, že hypotéza výzkumníka je správná, je ta, která obsahuje:
a) bramborová kostka v roztoku s pH = 9
b) kus masa v roztoku s pH = 5
c) vařený vaječný bílek v roztoku s pH = 9
d) část nudlí v roztoku s pH = 5
e) máslová koule v roztoku s pH = 9
Správná alternativa: b) kus masa v roztoku s pH = 5.
Proteáza je enzym, který štěpí bílkoviny, a protože je žaludeční, působí v žaludku, jehož pH je kyselé.
Při analýze alternativ musíme:
a) NESPRÁVNÉ. Brambory mají vysoký obsah sacharidů a pH koncentrátu je zásadité.
b) SPRÁVNĚ. Maso obsahuje bílkoviny a mohou na něj působit enzymy a pH koncentrátu je kyselé jako žaludek.
c) NESPRÁVNÉ. PH koncentrátu je zásadité.
d) NESPRÁVNÉ. Těstoviny jsou bohaté na sacharidy.
e) NESPRÁVNÉ. PH koncentrátu je zásadité.
2. (Udesc / 2009) „Kyselý déšť“ je termín, který označuje srážky z atmosféry deště s větším než běžným množstvím kyseliny dusičné a sírové.
Prekurzory kyselých dešťů pocházejí jak z přírodních zdrojů, jako jsou sopky a rozpadající se vegetace, tak z procesů průmyslové emise, zejména oxid siřičitý a oxidy dusíku ze spalování paliv fosilie.
PH dešťové vody považované za normální je 5,5 (kvůli přítomnosti kyseliny uhličité ze solubilizace oxidu uhličitého). Chemik sledující vysoce industrializovanou oblast zaznamenal, že pH dešťové vody bylo 4,5.
Vzhledem k tomu, že kyselost souvisí s koncentrací H3Ó+, je správné říci, že voda s pH 4,5 byla:
a) dvakrát tak základní jako obvykle.
b) dvakrát tak kyselý jako obvykle.
c) desetkrát základní než obvykle.
d) desetkrát kyselejší než obvykle.
e) stokrát kyselější než obvykle.
Správná alternativa: d) desetkrát kyselejší než obvykle.
Podle výrazů pH = - log [H+] a [H+] = 10-pH, Musíme:
pH = 5,5
[H+] = 10-5,5
pH = 4,5
[H+] = 10-4,5
Rozdíl mezi hodnotami je: 10- 5,5 - ( - 4,5) = 10 -1
Protože stupnice pH je logaritmická stupnice, změna jedné jednotky se rovná 10krát kyselějšímu roztoku.
3. (UFMG / 2009) Zvažte určité množství vody a citronové šťávy, smíchané, obsažené ve sklenici. Projděte si tato tři prohlášení týkající se tohoto systému:
I. Systém je kyselý.
II. PH systému je vyšší než 7.
III. V systému je koncentrace iontů H+ je větší než OH–.
Na základě této analýzy je SPRÁVNÉ konstatovat, že:
a) správná jsou pouze tvrzení I a II.
b) správná jsou pouze tvrzení I a III.
c) správná jsou pouze tvrzení II a III.
d) všechny tři výroky jsou správné.
Správná alternativa: b) správná jsou pouze tvrzení I a III.
I. OPRAVIT Citron obsahuje kyselinu citronovou, která v roztoku uvolňuje ionty H.+ a tak je systém kyselý.
II. ŠPATNĚ. Hodnota pH je nižší než 7, což charakterizuje kyselý systém: čím je pH roztoku blíže k 0, tím je kyselější.
III. OPRAVIT Kyselé pH je výsledkem vysoké koncentrace iontů H+ v roztoku, protože pH = - log [H+].
U dalších otázek s komentovaným rozlišením nezapomeňte zkontrolovat:Cvičení na pH a pOH.

