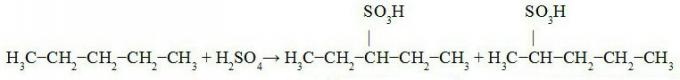Důkazem reakce je transformace, ke které dochází u látek ve vztahu k jejich počátečnímu stavu, tyto modifikace závisí na typu reakce, kterou reaktanty projdou.
Existuje několik kritérií pro klasifikaci chemických reakcí, jedno z nich se týká počtu látek, které reagují (reaktanty), a počtu vyráběných látek (produktů). Pro lepší ilustraci použijeme písmena: THE, B, C, X, Y.
Syntéza nebo adiční reakce: jsou látky, u nichž dvě nebo více látek pochází z jednoho produktu.
A + B → C
Příklad této reakce: když hořčík reaguje s kyslíkem ve vzduchu:
2 mg (y) + 1 O.2(g) → 2MgO (s)
Tato reakce je přítomna v jednorázových fotografických záblescích a signálních raketách.
Analýza nebo rozkladná reakce: při této reakci generuje jedna látka dva nebo více produktů.
THE → B + C
Některé reakce dostávají speciální názvy:
Elektrolýza: látky se rozkládají průchodem elektrického proudu.
Fotolýza: chemický rozklad světlem.
Pyrolýza: rozklad působením tepla a ohně.
Příklad: Airbagy jsou bezpečnostní zařízení přítomná v mnoha automobilech. Když spustíme toto zařízení, dojde k rychlému rozkladu sodné sloučeniny NaN
Nepřestávejte... Po reklamě je toho víc;)
2 NaN3(s) → 3 N.2(g) + 2 Na (s)
Jednoduchá výměna nebo vytěsňovací reakce: nastává, když jednoduchá látka reaguje se sloučeninou a vznikají nové látky: jedna jednoduchá a jedna sloučenina.
A + XY → Y + X
Příklad: Když se list zinku zavede do vodného roztoku kyseliny chlorovodíkové, vytvoří se chlorid zinečnatý a uvolní se plynný vodík.
Zn (s) + 2 HCl (vodný) → ZnCl2(aq) + H2 (G)
Všimněte si, že zinek vytlačil vodík, odtud název „vytěsňovací reakce“.
reakce dvojité výměny: reagují dvě činidla a tvoří dva produkty, to znamená, že pokud reagují dvě složené látky za vzniku nových sloučenin, dostanou tento název.
AB + XY → Y + XB
Příklad: Reakcí mezi kyselinou sírovou a hydroxidem barnatým se získá voda a síran barnatý.
H2POUZE4 (aq) + Ba (OH)2(aq) → 2 H2O (1) + BaSO4(s)
Produkt síranu barnatého: BaSO4(s) je nerozpustná bílá sůl.
Líria Alves
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
SOUZA, Líria Alves de. „Druhy chemických reakcí“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/tipos-reacoes-quimicas.htm. Zpřístupněno 27. června 2021.