Oxidačně-redukční reakce studované hlavně ve fyzikální chemii jsou reakce, při kterých dochází k elektronovému přenosu. Reagující druh (atom, iont nebo molekula), který ztrácí jeden nebo více elektronů, je ten, který prochází oxidací. Chemické druhy, které přijímají elektrony, jsou naopak redukovány.
Obecně, když se tento typ reakce studuje v anorganické chemii, nazývá se to jednoduchá výměnná reakce nebo posunutí.
Aby k jakékoli reakci došlo, je nutné splnit určité podmínky. Jedním z nich je, že musí existovat chemická afinita mezi činidly, to znamená, že musí interagovat takovým způsobem, aby umožňovaly tvorbu nových látek.
V případě redoxních reakcí afinita znamená, že jeden z reaktantů má tendenci získávat elektrony a druhý má sklon ke ztrátě elektronů. Tento trend odpovídá reaktivita zúčastněných chemických prvků.
Podívejme se, jak je možné porovnat reaktivitu mezi kovy.
Předpokládejme, že chceme skladovat roztok síranu měďnatého II (CuSO4). Toto řešení jsme pravděpodobně nemohli umístit do hliníkové nádoby, protože by došlo k následující reakci:
2 Al(s) + 3 CuSO4 (aq)→ 3 Cu(s) + Al2(POUZE4)3 (aq)
Všimněte si, že hliník oxidoval, každý ztratil 3 elektrony a stal se hliníkovým kationem:
Al(s) → Al3+(tady) + 3 a-
Současně kation mědi (Cu2+), který byl v roztoku přítomen, přijímal elektrony z hliníku a redukoval je a stal se kovovou mědí. Každý kation mědi přijímá dva elektrony:
Osel2+(tady) + 2 a- → Cu(s)
Pokud by to však bylo obráceně a chtěli jsme uložit roztok síranu hlinitého (Al2(POUZE4)3 (aq)), nebyl by problém dát jej do měděné nádoby, protože by k této reakci nedošlo:
Osel(s) + Al2(POUZE4)3 (aq) → nedochází
Tyto pozorované skutečnosti lze vysvětlit skutečností, že hliník je reaktivnější než měď.
Kovy mají tendenci vzdát se elektronů, to znamená oxidovat. Při porovnávání různých kovů ten s největší tendencí darovat elektrony je nejreaktivnější. V důsledku toho je reaktivita kovů také spojena s jejich ionizační energie, tj. minimální energie potřebná k odstranění elektronu z plynného atomu v jeho základním stavu.
Nepřestávejte... Po reklamě je toho víc;)

Na základě toho fronta reaktivity kovů nebo řada elektrolytických napětí, je uvedeno níže:
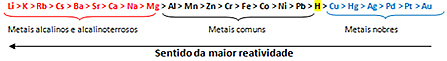
Nejreaktivnější kov reaguje s iontovými látkami, jejichž kationty jsou méně reaktivní. Jinými slovy, kov nalevo reaguje s látkou tvořenou ionty napravo. Opak se neděje.
Vzpomeňte si na uvedený příklad a v řádku reaktivity uvidíte, že hliník (Al) je nalevo od mědi (Cu). Proto hliník reaguje s roztokem tvořeným kationty mědi; ale měď nereaguje s roztokem tvořeným kationty hliníku.
Všimněte si, že nejreaktivnějším kovem je lithium (Li) a nejméně reaktivním je zlato (Au).

To je jeden z důvodů, proč je zlato tak cenné, protože pokud nereaguje, zůstává dlouho nedotčené. To lze vidět na pozlacených egyptských sarkofágech a sochách, které pocházejí z nejvzdálenějšího starověku. Vizualizujeme to také při porovnání trvanlivosti šperků z čistého zlata se šperky vyrobenými z jiných kovů, které jsou reaktivnější než zlato.

Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Řád reaktivity kovů"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/ordem-reatividade-dos-metais.htm. Zpřístupněno 28. června 2021.