ال نظرية الثماني ينص على أنه لكي تكون ذرة عنصر كيميائي مستقرة ، يجب أن تكتسب التكوين الإلكتروني للغاز النبيل ، أي ، يجب أن تحتوي على ثمانية إلكترونات في غلاف التكافؤ أو إلكترونين إذا كانت الذرة تحتوي على غلاف الإلكترون الأول فقط. (ك).
يحتوي البريليوم على عدد ذري يساوي 4. لذلك ، تحتوي ذرتك على 4 إلكترونات ويتم توزيعها الإلكتروني في الحالة الأرضية من خلال:

التكوين الإلكتروني البريليوم
هذا يعني أن البريليوم يحتوي على إلكترونين في غلافه الأخير ، من عائلة 2A (معادن الأرض القلوية). وبالتالي ، فإنه يميل إلى التبرع بهذين الإلكترونين ، والحصول على الشحنة 2+ ، أي أنه يميل إلى تكوين روابط أيونية.
ومع ذلك ، لوحظ أن ذرات البريليوم تصنع روابط تساهمية ، مع مشاركة الإلكترون ، كما هو موضح في المركب المتكون أدناه ، هيدريد البريليوم (BeH2):
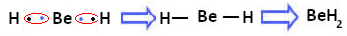
تكوين روابط تساهمية من البريليوم مع الهيدروجين
لاحظ أنه ، في هذه الحالة ، يكون البريليوم مستقرًا مع أقل من ثمانية إلكترونات في غلاف التكافؤ ، لأن تشترك في إلكتروناتها مثل ذرات الهيدروجين ، فلديها الآن أربعة إلكترونات في آخرها طبقة. ومن ثم فهو استثناء لقاعدة الثمانيات.
لكن الرابطة التساهمية تحدث عادة لأن العنصر يحتوي على مدارات غير كاملة. على سبيل المثال ، كما هو موضح أدناه ، يحتوي الهيدروجين على مدار غير مكتمل ، لذلك فهو يصنع رابطة تساهمية واحدة فقط. يحتوي الأكسجين على مدارين غير مكتملين ويصنع رابطتين تساهمية. يحتوي النيتروجين بدوره على ثلاثة مدارات غير مكتملة ، وبالتالي يصنع ثلاثة روابط تساهمية:
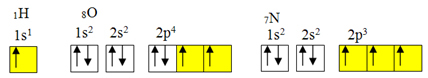
التوزيعات الإلكترونية للهيدروجين والأكسجين والنيتروجين
ومع ذلك ، كما هو موضح بالفعل ، لا يحتوي البريليوم على مدارات غير كاملة.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
فلماذا يصنع روابط تساهمية؟
التفسير في نظرية التهجينالذي يقول ذلك عندما يتلقى إلكترون من مدار طاقة ، فإنه "يقفز" إلى مدار خارجي فارغ ، البقاء في حالة الإثارة وبالتالي يحدث اندماج أو اختلاط المدارات الذرية غير المكتملة ، توليد مدارات هجينة المتكافئة مع بعضها البعض ومختلفة عن المدارات النقية الأصلية.
على سبيل المثال ، في حالة البريليوم ، يتلقى إلكترونًا من المستوى الفرعي 2 طاقة ويمرر إلى مدار 2p مستوى ثانوي كان فارغًا:

متحمس حالة البريليوم لتشكيل المدارات الهجينة
بهذه الطريقة ، يحتوي البريليوم على مدارين غير مكتملين ، مما يجعله قادرًا على تكوين رابطتين تساهمية.
لاحظ أن أحد المدارات يقع في مستوى فرعي "s" والآخر في "p" ، لذا يجب أن تكون الارتباطات التي يؤديها البريليوم مختلفة. ومع ذلك ، هذا ليس ما يحدث ، لأنه مع ظاهرة تهجين، فإن هذه المدارات غير المكتملة التي تشكلت سوف تختلط ، وتولد مداريتين تسمى الهجينة أو مهجن، والتي تتساوى مع بعضها البعض. علاوة على ذلك ، نظرًا لأن هذين المداريين الهجينين أتيا من مدار "s" و "p" ، فإننا نقول أن هذا التهجين من النوع ص:

تشكيل sp تهجين البريليوم
نظرًا لأن المدارات الهجينة هي نفسها ، فإن الروابط التساهمية التي يصنعها البريليوم مع ذرات الهيدروجين ستكون هي نفسها أيضًا:

تداخلات مدارات البريليوم الهجينة مع مدارات الهيدروجين
لاحظ أنه يصنع بعد ذلك سندات سيجما من النوع s-sp (σs-sp).
بقلم جينيفر فوغاسا
تخرج في الكيمياء

