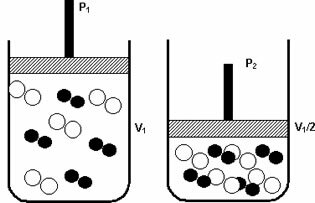
ا حساب عدد الجسيمات في الحل هو جانب أساسي بالنسبة لنا لقياس تأثير جماعي (تنظير, تنظير البرد, التنظير و تنظير الصوت) ناتج عن إضافة مذاب إلى مذيب معين.
أكبر كمية الجسيمات في المذاب الموجود في المحلول ، كلما كان التأثير التجميعي أكثر كثافة. يأخذ حساب عدد الجسيمات في الاعتبار بشكل أساسي طبيعة المادة المذابة التي تمت إضافتها.
يتم تصنيف المذاب فيما يتعلق بطبيعته على النحو التالي:
المذاب الجزيئي
إنه المذاب غير القادر على معاناة ظاهرة التفكك أو التأينبغض النظر عن المذيب الذي تمت إضافته إليه. أمثلة: الجلوكوز والسكروز والإيثيلين جلايكول إلخ.
وبالتالي ، نظرًا لأن المذاب الجزيئي لا يتأين أو ينفصل ، إذا أضفنا 15 جزيءًا (جزيئًا) منه إلى المذيب ، فسيكون لدينا 15 جزيءًا مذابًا.
المذاب الأيوني
إن المذاب ، عند إضافته إلى المذيب ، يخضع لظاهرة التأين (إنتاج الكاتيونات والأنيونات) أو التفكك (إطلاق الكاتيونات والأنيونات). أمثلة: الأحماض ، القواعد ، الأملاح ، إلخ.
لذا ، إذا أضفنا 15 جزيءًا منه إلى المذيب ، فسيكون لدينا 15 جسيمًا زائد س جسيم.
عامل تصحيح Van't Hoff
طور العالم Van't Hoff صيغة لحساب عامل التصحيح لـ عدد جسيمات المذاب الأيوني في حل.
أنا = 1 + α. (س -1)
يجرى:
أنا = عامل تصحيح Van't Hoff.
α = درجة التفكك أو تأين المذاب ؛
q = عدد الجسيمات التي تم الحصول عليها من تفكك أو تأين المذاب ؛
يجب استخدام عامل التصحيح Van't Hoff لمضاعفة القيمة الموجودة لملف عدد الجسيمات في المحلول. لذلك ، على سبيل المثال ، إذا كان عامل التصحيح 1.5 وعدد جسيمات المذاب في المحلول 8.5.1022، سيكون لدينا:
عدد الجسيمات الحقيقية للمذاب في المحلول = 1.5. 8,5.1022
عدد الجسيمات الحقيقية للمذاب في المحلول = 12.75.1022
أو
عدد الجسيمات الحقيقية للمذاب في المحلول = 1،275.1023
أمثلة على حساب عدد الجسيمات في محلول
مثال 1: حساب عدد الجزيئات الموجودة في محلول يحتوي على 45 جرامًا من السكروز (C6ح12ا6) مذاب في 500 مل من الماء.
بيانات التمرين:
الكتلة الذائبة = 45 جرام ؛
حجم المذيب = 500 مل.
قم بما يلي:
1ا خطوة: تحديد الكتلة المولية للمذاب.
لتحديد كتلة المذاب ، ما عليك سوى ضرب الكتلة الذرية للعنصر في عدد الذرات الموجودة فيه في الصيغة. ثم اجمع كل النتائج.
الكربون = 12.12 = 144 جم / مول
الهيدروجين = 1.22 = 22 جم / مول
الأكسجين = 16.11 = 196 جم / مول
الكتلة المولية = 144 + 22 + 196
الكتلة المولية = 342 جم / مول
2ا خطوة: احسب عدد الجسيمات باستخدام قاعدة ثلاثة تتضمن عدد الجسيمات والكتلة.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
لتجميع قاعدة الثلاثة ، يجب أن نتذكر أنه في الكتلة المولية ، ترتبط الكتلة دائمًا بثابت أفوجادرو ، وهو 6.02.1023 كيانات (جزيئات أو ذرات ، على سبيل المثال). وهكذا ، بما أن السكروز له جزيئات ، لأنه جزيئي (يتكون من رابطة تساهمية) ، علينا أن:
342 جرامًا من السكروز 6.02.1023 الجزيئات
45 جرام سكروز x
342.x = 45. 6,02.1023
س = 270,9.1023
342
س = 0.79.1023 الجزيئات
أو
س = 7.9.1022 الجزيئات
المثال 2: احسب عدد الجسيمات الموجودة في محلول يحتوي على 90 جرامًا من كربونات البوتاسيوم (K.2كو3) مذاب في 800 مل من الماء. مع العلم أن درجة تفكك هذا الملح تبلغ 60٪.
بيانات التمرين:
الكتلة الذائبة = 90 جرام.
حجم المذيب = 800 مل ؛
α = 60٪ أو 0.6.
ل تحديد عدد الجسيمات المذابة في هذا المحلول ، من المثير للاهتمام أن يتم تطوير الخطوات التالية:
1ا خطوة: تحديد الكتلة المولية للمذاب.
لتحديد كتلة المذاب ، ما عليك سوى ضرب الكتلة الذرية للعنصر في عدد الذرات الموجودة فيه في الصيغة. ثم اجمع كل النتائج.
البوتاسيوم = 39.2 = 78 جم / مول
الكربون = 12.1 = 12 جم / مول
الأكسجين = 16.3 = 48 جم / مول
الكتلة المولية = 144 + 22 + 196
الكتلة المولية = 138 جم / مول
2ا خطوة: احسب عدد الجسيمات باستخدام قاعدة ثلاثة تتضمن عدد الجسيمات والكتلة.
لتجميع قاعدة الثلاثة ، يجب أن نتذكر أنه في الكتلة المولية ، ترتبط الكتلة دائمًا بثابت أفوجادرو ، وهو 6.02.1023 الكيانات (الصيغة الأيونية ، الجزيئات أو الذرات ، على سبيل المثال). وبالتالي ، نظرًا لأن الكربونات لها صيغة أيونية لأنها أيونية (تتكون من رابطة أيونية) ، يتعين علينا:
138 جرام كربونات 6.02.1023 الجزيئات
90 جرام كربونات x
138.x = 90. 6,02.1023
س = 541,8.1023
138
س = 6.02.1023 صيغة أيونات (جزيئات)
3ا خطوة: احسب عدد الجسيمات (q) من تفكك الملح.
في كربونات البوتاسيوم ، لدينا ذرتان من البوتاسيوم في الصيغة (K.2) ووحدة من أنيون CO3. إذن ، قيمة q لهذا الملح هي 3.
ف = 3
4ا خطوة: احسب من عامل تصحيح Van't Hoff.
أنا = 1 + α. (س -1)
أنا = 1 + 0.6. (3-1)
أنا = 1 + 0.6. (2)
أنا = 1 + 1.2
أنا = 2.2
5ا خطوة:تحديد عدد الجسيمات الحقيقية موجود في الحل.
لتحديد عدد الجسيمات الحقيقية في هذا المحلول ، اضرب ببساطة عدد الجسيمات المحسوبة في 2ا خطوة بخطوة عامل التصحيح المحسوب في 4ا خطوة:
ص = 6.02.1023. 2,2
ص = 13244.1023 حبيبات
بي ديوغو لوبيز دياس