في الحياة اليومية وفي المختبرات ، هناك ردود فعل وتحولات عفوية وأخرى غير عفوية. على سبيل المثال ، كل الاحتراق هو رد فعل تلقائي ، لأنه بمجرد أن يبدأ ، فإنه سيستمر حتى يتم استهلاك كل الوقود أو حتى نفاد كل الأكسجين.
من ناحية أخرى ، فإن التحليل الكهربائي هو عملية غير تلقائية ، يتم فيها تحويل الطاقة الكهربائية إلى طاقة كيميائية. مثال على ذلك هو التحليل الكهربائي لكلوريد الصوديوم (NaCl). عندما يتم تمرير تيار كهربائي فوق هذا الملح المصهور ، هناك تفاعلات أكسدة واختزال وتشكيل الصوديوم المعدني (Na(س)) وغاز الكلور (Cl2 (ز)). إذا توقفنا عن تشغيل التيار الكهربائي ، فلن يستمر التفاعل من تلقاء نفسه ، مما يدل على أنه ليس تلقائيًا.
يمكن قياس عفوية التفاعل باستخدام معادلة جيبس هيلمهولتز، المعطى أدناه:

على ماذا:
∆G = تباين في الطاقة الحرة ؛
∆H = تغيير المحتوى الحراري ؛
T = درجة الحرارة بالكلفن (موجبة دائمًا) ؛
∆S = تغيير الكون.
تأخذ هذه المعادلة اسمها لأنها اقترحها الفيزيائي الأمريكي ج. ويلارد جيبس (1839-1903) والفيزيائي الألماني هيرمان هيلمهولتز (1821-1894).
لفهم كيف تساعدنا هذه المعادلة في تحديد عفوية التفاعل ، دعنا نراجع بإيجاز كل من المفاهيم المتضمنة فيها:
- ∆H (اختلاف المحتوى الحراري): المحتوى الحراري (H) هو محتوى الطاقة لمادة ما. حتى الآن ، لا توجد طريقة معروفة لتحديد ذلك. في الممارسة العملية ، ما يتم تحقيقه هو قياس تباين المحتوى الحراري (∆H) لعملية ما ، باستخدام المسعرات. هذا الاختلاف هو مقدار الطاقة التي تم إطلاقها أو امتصاصها في العملية.
- ∆S (اختلاف الانتروبيا):الانتروبيا (S) هي الكمية الديناميكية الحرارية التي تقيس درجة الاضطراب في النظام.
على سبيل المثال ، في حالة ذوبان الجليد ، تنتقل الجزيئات من الحالة الصلبة إلى الحالة السائلة ، حيث يكون هناك قدر أكبر من عدم التنظيم. هذا يعني أنه في هذه العملية زادت الإنتروبيا (∆S> 0).
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
في إنتاج الأمونيا (NH3) ، يتفاعل 1 مول من غاز النيتروجين مع 3 مول من غاز الهيدروجين (أي 4 مول من الجزيئات في المواد المتفاعلة) ، مما يعطي 2 مول من الأمونيا:
ن2 (ز) +3 ح2 (ز) → 2 نيو هامبشاير3 (ز)
نظرًا لأن عدد الجزيئات في الطور الغازي يتناقص في هذه العملية ، فقد انخفض عدم التنظيم ، مما يعني أن الانتروبيا انخفض أيضًا (∆S <0).
- ∆G (طاقة مجانية): طاقة مجانية أو جيبس الطاقة الحرة (لأنه تم اقتراحه فقط من قبل هذا العالم في عام 1878) هو الطاقة المفيدة للنظام المستخدمة للقيام بالعمل.
يحتوي النظام على طاقة عالمية ، ولكن سيتم استخدام جزء بسيط فقط من هذه الطاقة للقيام بالعمل ، وهذا ما يسمى طاقة جيبس الحرة ، والتي يرمز إليها بـ جي.
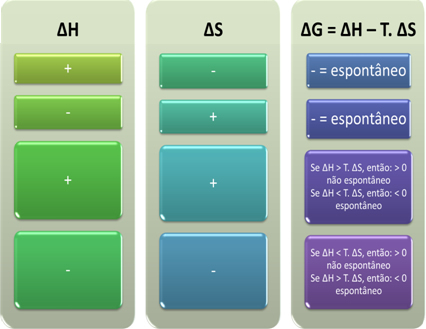
وفقا لجبس ، تعتبر العملية عفوية إذا كانت تؤدي عملاً ، أي إذا انخفض G. في هذه الحالة ، ستكون الحالة النهائية للتحول أكثر استقرارًا من الحالة الأولية عندما ∆G <0.
وبناءً على ذلك يمكن أن نستنتج ما يلي:

يمكننا أيضًا معرفة ما إذا كانت العملية ستكون تلقائية من خلال النظر إلى العلامة الجبرية لـ ∆H و S في معادلة Gibbs-Helmholtz:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "جيبس الطاقة الحرة"؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm. تم الوصول إليه في 28 يونيو 2021.