ال البطارية هو نظام يحدث فيه تفاعل الأكسدة والاختزال. في هذا الجهاز ، يتم تحويل الطاقة الكيميائية الناتجة عن التفاعل التلقائي إلى طاقة كهربائية.
تحدث تفاعلات الأكسدة والاختزال في وقت واحد في الخلية. عندما يخضع أحد الأنواع للأكسدة ، فإنه يتبرع بالإلكترونات للأنواع الأخرى ، والتي ، عند تلقيها ، تخضع للاختزال.
لذلك ، فإن العامل الذي يخضع للأكسدة هو عامل الاختزال والعامل الذي يخضع للاختزال هو العامل المؤكسد.
ال أكسدة يحدث عندما يفقد أحد الأنواع الإلكترونات ويصبح كاتيونًا: A → A+ + و-.
ال اختزال يحدث عندما يكتسب أحد الأنواع إلكترونات ويصبح محايدًا كهربائيًا: ب+ + و- → ب.
في المعادلات الكيميائية ، هذا نقل الإلكترون يتضح من خلال التغيير في رقم الأكسدة (أكسيد النيتروجين).
تحدث تفاعلات الاختزال داخل الخلايا وينشأ التيار الكهربائي مع هجرة الإلكترونات من القطب السالب إلى القطب الموجب.

كيف يعمل المكدس؟
واحد رد فعل الأكسدة يمكن تمثيلها بشكل عام بالمعادلة:
أ + ب+ → أ+ + ب
أين،
ج: المادة التي تتأكسد وتفقد الإلكترونات وتزيد من قيمتها وهي العامل المختزل.
ب: المادة التي تخضع للاختزال وتكتسب الإلكترونات وتقلل من الأكسدة وهي العامل المؤكسد.
انظر في الصورة التالية كيف يمكن تمثيل هذه العملية.
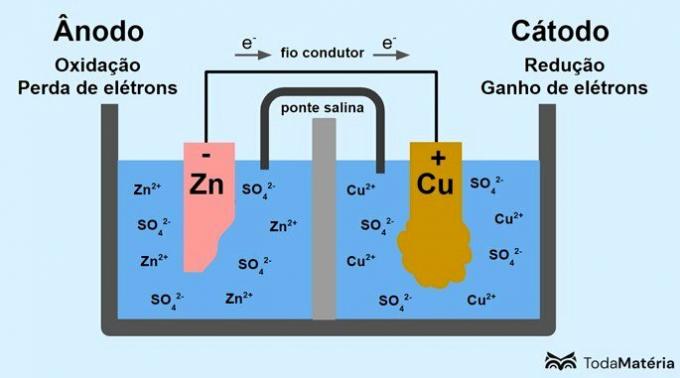
تم تقسيم النظام إلى قسمين شبه جزئين ويتكون من قطبين معدنيين متصلين خارجيًا بواسطة سلك موصل تم تطويره بواسطة جون فريدريك دانييل (1790-1845) في عام 1836.
تتكون البطارية من قطبين كهربائيين ، متصلين بسلك موصل ، وإلكتروليت ، حيث توجد الأيونات. القطب الكهربائي هو سطح موصل صلب يسمح بتبادل الإلكترونات.
الأنود: القطب الذي تحدث فيه الأكسدة. إنه أيضًا القطب السالب للبطارية.
كاثود: القطب الذي يحدث فيه التخفيض. إنه أيضًا القطب الموجب للبطارية.
في الصورة أعلاه ، الزنك المعدني هو الأنود ويخضع لـ أكسدة. النحاس المعدني هو الكاثود ويخضع للاختزال. يحدث هجرة الإلكترونات (e-) من القطب الموجب إلى الكاثود عبر السلك الموصل.
التفاعلات التي تحدث في نظام الصور هي:
- الأنود (أكسدة): Zn(س) → زد2(هنا) + 2 هـ-
- كاثود (تخفيض): نحاس2+(هنا) + 2 هـ- → الحمار(س)
- معادلة عامة: Zn(س) + الحمار2+(هنا) → الحمار(س) + زنك2+(هنا)
الزنك هو معدن يميل بشكل أكبر إلى فقدان الإلكترونات ، وبالتالي تتشكل الكاتيونات في المحلول. يبدأ القطب الكهربائي للزنك في التآكل وفقدان الكتلة لأن الزنك يتم إطلاقه في المحلول عند تكوين كاتيونات الزنك2+.
تصل الإلكترونات من القطب الموجب إلى القطب السالب وتتحول الكاتيونات المعدنية عند استقبالها إلى نحاس معدني يترسب على القطب ويزيد من كتلته.
جسر الملح عبارة عن تيار أيوني مسؤول عن دوران الأيونات في النظام لإبقائه محايدًا كهربائيًا.
اقرأ أيضًا عن رقم الأكسدة (أكسيد النيتروجين).
أنواع البطاريات
في الخلية ، يتم تحديد ميل الأنواع الكيميائية لتلقي الإلكترونات أو التبرع بها من خلال إمكانية الاختزال.
يميل المكون الذي يحتوي على أعلى إمكانات اختزال إلى الخضوع للاختزال ، أي اكتساب الإلكترونات. تميل الأنواع ذات إمكانات الاختزال الأقل ، وبالتالي أعلى إمكانات الأكسدة ، إلى نقل الإلكترونات.
على سبيل المثال ، في تفاعل الأكسدة والاختزال Zn0(س) + الحمار2+(هنا) → الحمار0(س) + زنك2+(هنا)
يتأكسد الزنك ويتبرع بالإلكترونات لأن له إمكانية اختزال E.0 = -0.76V ، أقل من إمكانية الاختزال للنحاس E.0 = + 0.34 فولت ، وبالتالي ، يستقبل الإلكترونات ويخضع للاختزال.
انظر أدناه للحصول على أمثلة أخرى من المداخن.
مكدس الزنك والهيدروجين
تفاعل نصف الأكسدة: Zn(س) → زد2+ + 2 هـ- (و0 = -0.76 فولت)
رد فعل نصف التخفيض: 2H+(هنا) + 2 هـ- → H.2 (ز) (و0 = 0.00 فولت)
المعادلة العالمية: Zn(س) + 2 ح+(هنا) → زد2+(هنا) + ح2 (ز)
تمثيل المكدس:
خلية نحاسية وهيدروجينية
تفاعل نصف الأكسدة: H2 (ز) → 2 ح+(هنا) + 2 هـ- (و0 = 0.00 فولت)
رد فعل نصف التخفيض: النحاس2+(هنا) + 2 هـ- → الحمار(س) (و0 = + 0.34 فولت)
المعادلة العالمية: Cu2+(هنا) + ح2 (ز) → 2 ح+(هنا) + الحمار(س)
تمثيل المكدس:
احصل على مزيد من المعرفة حول الموضوع مع المحتويات:
- الكيمياء الكهربائية
- التحليل الكهربائي
مراجع ببليوغرافية
فونسيكا ، م. تم العثور على R. م. الكيمياء ، 2. 1. إد. ساو باولو: أتيكا ، 2013.
سانتوس ، دبليو إل بي ؛ مول ، ج. كيمياء المواطن ، 3. 2. إد. ساو باولو: Editora AJS، 2013.
أوسبيركو ، ج. ربط الكيمياء ، 2: الكيمياء. - 2. إد. ساو باولو: ساريفا ، 2014.


