المحلول عبارة عن خليط متجانس من مادتين أو أكثر.. على سبيل المثال ، محلول ملح (مذاب) مذاب في الماء (مذيب).

هذه العملية مهمة للغاية خاصة في المختبرات والصناعات الكيميائية ، لأن الكيميائي يحتاج إلى تحضير حلول بتركيزات معروفة. علاوة على ذلك ، في الأنشطة التجريبية ، يتم استخدام المحاليل ذات التركيزات المنخفضة جدًا ، لذلك يتم تخفيف عينة من المحلول المركز إلى التركيز المطلوب.
بشكل يومي ، عدة مرات ، دون أن ندرك ذلك ، نقوم بعملية تخفيف الحلول. على سبيل المثال ، تنصح عبوات منتجات التنظيف والنظافة المنزلية ، مثل المطهرات ، بتخفيفها قبل الاستخدام. يقترح بعض المصنّعين على ملصقات المنتج أنه يتم تخفيفه بالماء بنسبة 1 إلى 3 ، أي لكل جزء من المنتج ، يجب إضافة 3 أجزاء من الماء. يتم ذلك لأن المنتج شديد التركيز وقوي ويمكن أن يلحق الضرر بالمكان الذي سيتم تطبيقه فيه إذا لم يتم تخفيفه بالطريقة الصحيحة. من ناحية أخرى ، إذا خففته أكثر مما ينبغي ، فقد تخسر المال ، لأن المنتج لن يحقق النتيجة المرجوة.

مثال آخر هو عندما نصنع العصائر. تشير ملصقات العديد من مركزات العصير إلى أنه يجب تخفيف كوب من العصير أو خلطه بخمسة أكواب من الماء. وبالتالي ، يصبح العصير "أضعف" ، أي أقل تركيزًا.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
تخيل أنك قد خففت مثل هذا العصير في 3 لترات من الماء. إذا كان تركيز العصير الأولي 40 جم / لتر ، فهذا يعني أنه يحتوي على كتلة 40 جم لكل لتر من المذيب. ولكن نظرًا لأن لدينا 3 لترات ، فسيتم تقسيم الكتلة على 3 وسيكون التركيز عندئذٍ حوالي 13 أو 33 جم / لترًا أو 13 جرامًا لكل لتر من المحلول. ومع ذلك ، في المحلول الكامل ، لا تزال كتلة 40 جم من المذاب متبقية.
يمكن حساب هذا التركيز الجديد على النحو التالي:
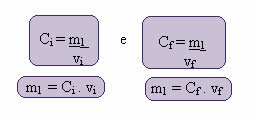
حيث يمثل الفهارس i و f ، على التوالي ، القيم الأولية والنهائية. نظرًا لأن قيمة m1 لم تتغير ، يمكننا معادلة المعادلات:
جأنا. الخامسأنا = جF. الخامسF
استبدال القيم التي لدينا ، وفقًا للمثال السابق ، لاحظ:
الحل الأولي:
جأنا: 40 جم / لتر
م 1: 40 جم
الخامسأنا: 1 لتر
حل نهائي:
جF: ?
م 1: 40 جم
الخامسF: 3 لتر
جأنا. الخامسأنا = جF. الخامسF
(40 جم / لتر). (1 لتر) = جF. 3 لتر
جF = 40 جم / لتر
3
جF = 13.333 جم / لتر
نفس المنطق صالح أيضًا للتركيز المولي (M) وللنسبة المئوية حسب كتلة المذاب أو العيار (T):
مأنا. الخامسأنا = مF. الخامسF و تيأنا. الخامسأنا = تF. الخامسF
بقلم جينيفر فوغاسا
تخرج في الكيمياء
فريق مدرسة البرازيل
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "تمييع الحلول" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. تم الوصول إليه في 27 يونيو 2021.