ال الذوبانيمكن تعريفها على أنها أقصى قدر ممكن من المذاب الذي يمكن إذابته في كمية معينة من المذيب عند درجة حرارة معينة.
يُعرف أيضًا هذا الحد الأقصى للكمية التي يمكن حلها باسم معامل الذوبان أو درجة الذوبان. لكن قابلية أي مادة للذوبان تعتمد ، من بين أمور أخرى ، على نوع المذيب الذي يتم فيه تشتيت المادة المذابة.
على سبيل المثال ، كلوريد الصوديوم (كلوريد الصوديوم - ملح الطعام) قابل للذوبان بشدة في الماء ، وفي لتر واحد من الماء عند درجة حرارة 20 درجة مئوية ، يمكننا إذابة ما يصل إلى 360 جرامًا من هذا الملح. ولكن عندما يتغير المذيب إلى البنزين ، في ظل نفس الظروف من حيث الحجم ودرجة الحرارة والضغط ، فإن الملح لا يذوب.
لماذا تختلف قابلية ذوبان مادة ما كثيرًا من مذيب إلى آخر؟
أحد العوامل هو قطبية من المركبات المعنية. في المثال المذكور ، لدينا أن الملح قطبي ، والماء قطبي ، والبنزين غير قطبي. يتكون الملح من ذرات الصوديوم (Na) والكلور (Cl) التي تترابط من خلال الروابط الأيونية ، حيث يتبرع الصوديوم بالتأكيد بإلكترون للكلور ، مكونًا أيونات الصوديوم.+ و Cl-. نظرًا لأن هذه الأيونات لها شحنة معاكسة ، فإنها تتجاذب وتتماسك معًا (Na+Cl-).

يوضح لنا هذا أن الملح قطبي حقًا ، وكل رابطة أيونية قطبية ، حيث يوجد اختلاف في الشحنة الكهربائية في المركب.
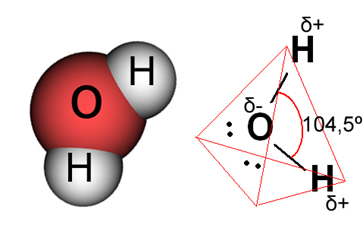
في حالة الماء ، تكون الرابطة الحالية تساهمية ، حيث تتشارك ذرتان من الهيدروجين الإلكترونات مع ذرة أكسجين. يحتوي جزيء الماء على اثنين من ثنائيات الأقطاب ، حيث يحتوي الأكسجين على شحنة سالبة جزئيًا وشحنة موجبة جزئيًا للهيدروجين (δ- O ─ H δ+). لكن ، هذه ثنائيات الأقطاب لا تلغي بعضها البعض ، لأن جزيء الماء يلتقي بزاوية 104.5 ، مما يدل على أن التوزيع والشحنة على طول الجزيء غير منتظم. هناك كثافة شحنة سالبة أكبر على ذرة الأكسجين للجزيء. يوضح لنا هذا أن جزيء الماء قطبي حقًا.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
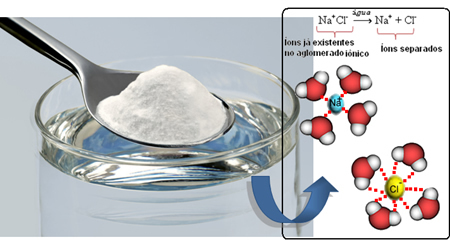
لذلك عندما نخلط الملح في الماء ، الجزء الموجب من الملح ، وهو كاتيونات الصوديوم.+، ينجذب إلى الجزء السلبي من الماء ، وهو الأكسجين ، والجزء السلبي من الملح (Cl الأنيونات-) بواسطة الجزء الموجب من الماء (H+). وبالتالي ، فإن الاتحاد Na+Cl- يتم تكسيرها ، مما يؤدي إلى إذابة الملح في الماء.
من ناحية أخرى ، يتكون البنزين من خليط من الهيدروكربونات المختلفة ، وهي غير قطبية ، أي أن توزيع الشحنة الكهربائية للبنزين منتظم. وبالتالي ، لا يوجد تفاعل بين أيونات الملح والبنزين ولا يذوب.
تقودنا هذه الحالات وغيرها إلى الاستنتاج التالي:

ومع ذلك ، لا يمكن اعتبار هذا قاعدة عامة ، حيث توجد العديد من حالات المواد المذابة غير القطبية التي تذوب جيدًا في المذيبات القطبية والعكس صحيح. لذا ، لفهم سبب حدوث ذلك ، علينا التفكير في عامل آخر: نوع قوة الجزيئات من المذيب والمذاب.
قانون حول هذا في النص: "العلاقة بين القوة بين الجزيئات وذوبان المواد”.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ بحث:
فوغا ، جينيفر روشا فارغاس. "العلاقة بين قطبية المواد وقابليتها للذوبان" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. تم الوصول إليه في 27 يوليو 2021.


