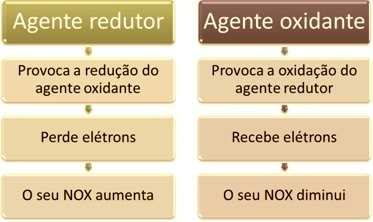
واحدة من السمات الرئيسية التي تميز تفاعل الأكسدة والاختزال (أو الأكسدة والاختزال) من العوامل الأخرى هو وجود عامل مؤكسد وعامل مختزل ، يمكن تعريفهما على النحو التالي:
على سبيل المثال ، انظر إلى التفاعل الكيميائي أدناه حيث يتآكل الألومنيوم (Al) في محلول حمض الهيدروكلوريك المائي (HCl). تنقل ذرات الألومنيوم الإلكترونات إلى كاتيونات H.+(هنا) وتنتج الكاتيون3+(هنا):
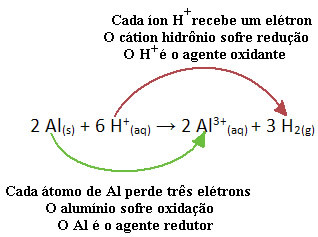
لاحظ أنه منذ نقل الإلكترونات Al ، فهذا يعني ذلك تسبب في التخفيض من الكاتيونات H.+(هنا); لهذا تم استدعاؤه الحد من وكيل. بالفعل الكاتيون H.+(هنا) إزالة الإلكترونات من الألومنيوم ، تسبب الأكسدة من هذا المعدن لذلك يتصرف بصفته أ عامل مؤكسد.
في الحياة اليومية ، هناك العديد من الأمثلة على أداء العوامل المؤكسدة والعوامل المختزلة. انظر إلى بعضها وتذكر ، مع ذلك ، أنه في جميع الحالات يحدث الاختزال في وقت واحد مع الأكسدة ؛ لذلك ، إذا كان هناك عامل مختزل ، فهناك أيضًا عامل مؤكسد.
- أمثلة على عوامل الاختزال:
- في الأفلام الفوتوغرافية: تحتوي أفلام التصوير الفوتوغرافي على أملاح فضية حساسة للضوء. في النقاط التي يوجد فيها سقوط للضوء يكون هناك انخفاض في أيونات Ag+، مما أدى إلى التباين الملحوظ في السلبيات.

- فيتامين سي: فيتامين ج (حمض الأسكوربيك) هو عامل اختزال قوي في محلول مائي. لديه وسيلة استثنائية للتأكسد وهذا هو السبب في استخدامه على نطاق واسع ، لا سيما في الأطعمة مثل مضادات الأكسدة ، أي تضاف إلى الأطعمة الأخرى وتحميها من الأكسدة المحتملة ، بسبب تناولها. تضحية. مثال على ذلك فواكه مثل التفاح والكمثرى التي تصبح داكنة عند ملامستها للأكسجين في الهواء لأنها تتأكسد. لكن عند إضافة كمية قليلة من عصير البرتقال أو الليمون (الذي يحتوي على فيتامين سي) إلى الفاكهة قطع ، وهذا يمنع حدوث هذا التفاعل ، لأن فيتامين C يعمل كعامل مختزل ويتأكسد قبل الفاكهة.

- غاز الهيدروجين: غاز الهيدروجين (H2) يستخدم في الدفع الصاروخي ويعتبر من أهم بدائل الطاقة حيث أن احتراقه يطلق كمية كبيرة من الطاقة ولا يسبب أي ملوثات. في هذا التفاعل ، يعمل الهيدروجين كعامل مختزل ، حيث يتأكسد بالأكسجين.
- أمثلة على العوامل المؤكسدة:
- في انتاج الخل: عندما يتعرض النبيذ للهواء ، يتحول إلى خل ، المكون الرئيسي منه هو حمض الأسيتيك. وذلك لأن كحول الإيثيل أو الإيثانول الموجود في النبيذ يتأكسد عند ملامسته للأكسجين الجوي ، مما ينتج عنه حمض الأسيتيك. وبالتالي ، فإن الأكسجين عامل مؤكسد. حتى أصل مصطلح "الأكسدة" يرتبط بالتفاعل مع الأكسجين.

لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
- في الصدأ: كما هو مذكور في المثال السابق ، يعمل الأكسجين كعامل مؤكسد للكحول ؛ وهو يفعل ذلك أيضًا عند ملامسته للعديد من المعادن ، مثل الحديد ، مما يتسبب في حدوث الصدأ. بالإضافة إلى الأكسجين الموجود في الهواء ، فإن العوامل المؤكسدة الأخرى في هذه الحالة هي الماء أو محلول حمضي.
- في المبيضات: يرجع تأثير التبييض إلى وجود عاملي الاختزال التاليين: o أنيون هيبوكلوريت (بشكل عام على شكل ملح الصوديوم - NaOCl) ، الموجود ، على سبيل المثال ، في التبييض ؛ وبيروكسيد الهيدروجين (H2ا2) ، يتم تسويقه على أنه بيروكسيد الهيدروجين. يمتلك هذان المركبان ميلًا قويًا جدًا للأكسدة ويؤديان إلى تقليل الأنواع الكيميائية الأخرى. لذلك ، فهي مسؤولة عن المواد المؤكسدة التي تضفي اللون الداكن على المنتجات. على سبيل المثال ، في السليلوز ، يتحلل اللجنين ويصبح أخف وزنا وأكثر مرونة. في حالة إزالة البقع وتبييض الأقمشة ، تتسبب هذه العوامل المؤكسدة في أكسدة الجزيئات العضوية مثل الدهون والأصباغ.

- في أجهزة التنفس: يتكون محلل التنفس البسيط القابل للتصرف من أنبوب شفاف يحتوي على محلول مائي من ملح ثنائي كرومات البوتاسيوم والسيليكا ، مبلل بحمض الكبريتيك ؛ ممزوج باللون البرتقالي. يتفاعل هذا الملح ، عند ملامسته لبخار الكحول الموجود في أنفاس السائق المخمور ، ويغير اللون إلى اللون الأخضر. هذا يعني أن أكسدة الإيثانول (الكحول) للإيثان تسبب.

بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "مفهوم وأمثلة لعامل الاختزال والعامل المؤكسد" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm. تم الوصول إليه في 28 يونيو 2021.
كيمياء

الفولاذ المقاوم للتآكل في الغلاف الجوي ، الكروم ، النيكل ، مصنوع من الحديد الخام في أفران الصهر ، مقاوم ل أكسدة درجات حرارة عالية ، فولاذ مقاوم للصدأ ، مجموعة سبائك حديدية مقاومة للأكسدة والتآكل ، إنتاج أجزاء للسيارة
كيمياء

كيف يعمل جهاز قياس الكحول ، تركيز الكحول ، جهاز قياس الكحول ، التفاعلات التي تشمل الكحول الإيثيلي ، أنواع مجازات التنفس ، ثاني كرومات البوتاسيوم ، خلية الوقود ، محفز ، إطلاق الإلكترون ، حمض الخليك ، الهيدروجين ، الحمل
كيمياء

العدسات الحساسة للضوء ، تفاعلات تقليل الأكسدة ، فقدان أو اكتساب الإلكترونات ، عدسات التمثيل الضوئي في النظارات الشمسية ، تكوين الزجاج اللوني ، ذرات الأكسجين رباعي السطوح ، التركيب البلوري لكلوريد الفضة ، الضوء فوق البنفسجي ، معدن الفضة


