الهاليد مركب عضوي يحتوي على ذرة هالوجين واحدة على الأقل. - أي العناصر الكيميائية من الأسرة 17 أو السابعة من الجدول الدوري (F ، Cl ، Br ، I أو بشكل عام: X) - مرتبطة بمجموعة مشتقة من الهيدروكربون.
RX (حيث X = F أو Cl أو Br أو I)
بعض الهاليدات موضحة أدناه:

اليود هو الأكثر تفاعلًا على الإطلاق والفلور هو الأقل ، لأن طاقة الربط بين الهالوجين والكربون تزداد من اتجاه اليود إلى الفلور.
نقطة أخرى هي أن التفاعل يزيد أيضًا بهذا المعنى:

وبالتالي ، فإن هذا التفاعل يحدث بسهولة أكبر في هاليدات الكربون من الدرجة الثالثة ، بسبب الخاصية المكتسبة بواسطة الكربون المرتبط بالهاليد العضوي:

وبالتالي ، فإن المجموعة البديلة ، مثل OH التي ستشكل الكحول ، تنجذب بقوة أكبر إلى الكربون العالي ، الذي له طابع إيجابي (1+) ، والاستبدال أسهل.
يمكن أن تخضع الهاليدات للتفاعلات التي تسمح لنا بالحصول عمليًا على جميع الوظائف العضوية الأخرى (الكحول ، الأثير ، الألكين ، السيانيد أو النتريل ، الأمين ، من بين أمور أخرى). ومع ذلك ، فإن هذا غير ممكن عمليًا لأن الهاليدات مركبات باهظة الثمن.
لإنتاج كحول ، على سبيل المثال ، يتفاعل هاليد مع قاعدة قوية ، مثل هيدروكسيد الصوديوم ، في وسط مائي. دعونا نرى مثالاً أدناه ، والذي من التحلل المائي القلوي لكلوريد الإيثيل (كلورو إيثان) سيتم تكوين الإيثانول:
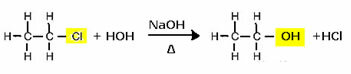
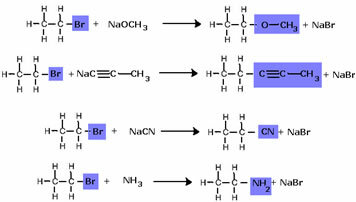
لاحظ أنه تم استبدال مجموعة الهاليد بـ OH ، مجموعة الكحول الوظيفية. يتم اتباع نفس المخطط لتشكيل مجموعات أخرى ، مع التفريق بين الكاشف فقط:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
فريق مدرسة البرازيل
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/reacoes-substituicao-haletos-organicos.htm
