ترتبط قطبية الرابطة والجزيء بتوزيع الإلكترونات حول الذرات.إذا كان هذا التوزيع متماثلًا ، فسيكون الجزيء غير قطبي ، ولكن إذا كان غير متماثل ، وأحد أجزاء الجزيء له كثافة إلكترون أعلى ، لذلك إنه جزيء قطبي.
يمكن تصور قطبية الجزيئات عندما تتعرض المادة المكونة لها لمجال كهربائي خارجي. إذا كانت الجزيئات توجه نفسها في وجود هذا المجال ، بمعنى ، إذا انجذب جزء إلى القطب الموجب والجزء الآخر من الجزيء ينجذب إلى القطب السالب ، هم قطبيون. غير ذلك، إذا لم يوجهوا أنفسهم ، فهم غير قطبيين.
على سبيل المثال ، عندما تقوم بفرك عصا زجاجية بالفانيلا كثيرًا ، فإنها تصبح مشحونة بشكل إيجابي. إذا اقتربنا منه إلى تيار من الماء يتساقط من الصنبور ، فسنرى أن الماء لن يستمر في الانخفاض في مسار رأسي مستقيم ، ولكن سوف ينجذب بواسطة العصا ، مما يؤدي إلى انحراف. هذا يدل على أن الماء قطبي. لكن إذا أجرينا نفس التجربة بشريحة من الزيت ، فلن تنحرف في مسارها ، مما يدل على أن جزيئاتها غير قطبية.
من خلال تحليل هياكل الجزيئات ، يمكننا تحديد ما إذا كانت قطبية أم لا ، مع الأخذ في الاعتبار عاملين مهمين: الفرق في الكهربية بين الذرات وهندسة الجزيء.
1) الكهربية بين الذرات:
إذا كان الجزيء يتكون من روابط بين ذرات نفس العناصر الكيميائية ، أي إذا كانت مواد بسيطة مثل O2، ح2، لا2، C2، ص4، س8، وما إلى ذلك ، ستكون غير قطبية ، لأنه لا يوجد فرق في الكهربية بين ذراتها.
الاستثناء الوحيد هو جزيء الأوزون (O3) ، والذي سيظهر لاحقًا.
إذا كان الجزيء ثنائي الذرة ومتكونًا من عناصر ذات سلبيات كهربائية مختلفة ، فسيكون الجزيء قطبيًا. أمثلة: HCℓ و HF و HBr و HI.
ثانيًا) هندسة الجزيئات:
تؤثر هندسة الجزيء على كيفية توزيع الإلكترونات فيه ، وبالتالي على قطبيته. إذا كان الجزيء مكونًا من ثلاث ذرات أو أكثر ، فسيتعين علينا تحليل كل رابطة يتم تكوينها وهندسة الجزيء. شاهد مثالاً: CO2 - الجزيء الخطي:
δ- δ+ δ-
O = C = O
لاحظ أن الأكسجين أكثر كهرسلبية من الكربون ، لذلك فإن إلكترونات الرابطة تنجذب أكثر إلى الأكسجين. تتشكل فيها شحنة سالبة جزئية (δ-) ، بينما في الكربون تتشكل شحنة موجبة جزئية (δ+). يُطلق على عملية ضرب المسافة بين نوى الذرات المرتبطة بهذه الشحنات في المعامل (أي فقط الرقم بدون علامة زائد أو ناقص) عزم ثنائي الاقطاب ويمثلها μ.
μ = د. |δ|
يشار إلى هذه العزم ثنائي القطب بأسهم تشير في اتجاه العنصر الأكثر كهرسلبية ، والذي يجذب الإلكترونات: O ← C → O. يوضح هذا أن هذه الكمية متجه (كمية لها مقدار أو شدة واتجاه واتجاه). لذلك ، يتم تمثيلها بشكل أفضل من خلال:  .
.

بجمع جميع المتجهات معًا ، نجد العزم ثنائي القطب الناتج ، 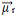 ، والتي كانت في هذه الحالة تساوي صفرًا لأن لحظتي ثنائي القطب لهما قيم متساوية ، لكنهما يسيران في اتجاهين متعاكسين ، ويلغي أحدهما الآخر.
، والتي كانت في هذه الحالة تساوي صفرًا لأن لحظتي ثنائي القطب لهما قيم متساوية ، لكنهما يسيران في اتجاهين متعاكسين ، ويلغي أحدهما الآخر.
عندما يكون متجه العزم ثنائي القطب الناتج مساويًا للصفر ، يكون الجزيء غير قطبي ، ولكن إذا كان غير صفري ، فسيكون قطبيًا.
لذلك ، في حالة جزيء ثاني أكسيد الكربون2، هي أبولار.
انظر الآن إلى مثال آخر: H2O - الهندسة الزاوية (لأن الأكسجين يحتوي على زوجين من الإلكترونات المتوفرة في المستوى الخارجي ، والتي تصد الإلكترونات من الروابط مع الهيدروجين):
تنجذب الإلكترونات إلى الأكسجين. لكن ، في هذه الحالة ، لا تلغي المتجهات بعضها البعض ، لأن الهندسة الجزيئية للماء زاويّة ، لأن اتجاهاتها ليست معاكسة ، مما يعطي متجه عزم ثنائي القطب ناتج غير صفري ، وبالتالي يكون جزيء الماء قطبي.
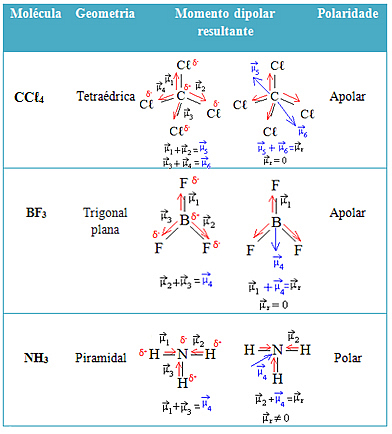
انظر المزيد من الأمثلة في الجدول أدناه:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/polaridade-das-moleculas.htm


