ال تحلل الملح بين الأحماض والقواعد القوية يحدث عندما لا يتفاعل الكاتيون الموجود في الملح مع الأنيون في الماء ، ولا يتفاعل الأنيون الموجود في الملح مع الكاتيون في الماء. يحدث التحلل المائي بين الكاتيونات وأنيونات الملح والماء فقط عندما يكون المنتج المتكون عبارة عن حمض ضعيف أو قاعدة ضعيفة أو كليهما. افهم التحلل المائي للملح بين الأحماض القوية والقواعد القوية خطوة بخطوة:
أ) الخطوة 1: تأين الماء
الماء مادة لها القدرة على المعاناة التأين الذاتي، أي أنه ينتج الهيدرونيوم كاتيون (H+) وأنيون الهيدروكسيد (OH-) من هيكلها.
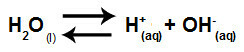
معادلة تمثل التأين الذاتي للماء
ب) الخطوة 2: التفكك من الملح
عندما يضاف الملح إلى الماء ، فإنه يمر بعملية التفكك. نظرًا لأن الملح مركب أيوني ، في الماء ، يتم إطلاق كاتيوناته وأنيوناته في الوسط ، كما في المعادلة الموضحة أدناه:
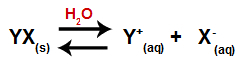
معادلة تمثل تفكك أي ملح
ج) الخطوة 3: التحلل المائي للأحماض والقواعد القوية
لحمض قوي: عندما يتحد أنيون الملح مع H.+ من الماء لتكوين HCl أو HBr أو HI أو حمض آخر يكون فيه طرح عدد الأكسجين من خلال عدد الهيدروجين مساويًا أو أكبر من 2 ، سيكون لدينا حامض قوي. لذلك ، لا يحدث الجمع بين الأيونات المذكورة.
لأساس قوي: عندما يتم دمج كاتيون الملح الذي ينتمي إلى IA (الفلزات القلوية) أو IIA (معادن الأرض القلوية غير المغنيسيوم) مع OH- من الماء ، فإنه سيشكل أسس قوية. لذلك ، لا يحدث الجمع بين الأيونات المذكورة.
عندما لا تتفاعل أيونات الملح مع أيونات الماء ، لدينا المعادلة التالية:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
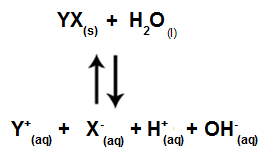
معادلة توضح جميع الأيونات الموجودة في المحلول
باختصار ، نظرًا لأن أيونات الملح لا تتفاعل مع أيونات الماء ، فإن أيونات الملح لا تعزز أي تغيير في المحلول النهائي. وبالتالي ، يمكننا كتابة معادلة التحلل المائي للملح بين الأحماض القوية والقواعد القوية فقط باستخدام معادلة التأين المائي.
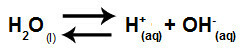
معادلة تمثل التحلل المائي للأحماض والقواعد القوية
د) مثال على التحلل المائي للملح بين الأحماض والقواعد القوية
عندما نضيف ملح كلورات البوتاسيوم إلى الماء (KClO3) ، ينفصل الملح ويطلق كاتيون البوتاسيوم (K.+) وأنيون الكلورات (ClO3-) في المنتصف.
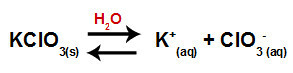
معادلة تفكك كلورات البوتاسيوم
من المهم أن نتذكر أن الماء يخضع للتأين الذاتي ويزود الوسط بهيدرونيوم كاتيون (H+) وأنيون الهيدروكسيد (OH-). يجب علينا الآن تقييم التفاعل بين أيونات الملح والماء.
عندما يكون H+ يتفاعل مع ClO3-، فإنه يشكل حمض البيركلوريك (HclO3). نظرًا لأن طرح عدد الأكسجين من خلال عدد الهيدروجين المتأين في حمض البيركلوريك هو 2 ، فهو قوي. لذلك ، لا يحدث التفاعل بين الأيونات.
عندما الكاتيون K.+ يتفاعل مع أنيون OH-، لدينا تكوين قاعدة قوية ، حيث أن البوتاسيوم معدن قلوي. لذلك ، لا يحدث التفاعل بين الأيونات.
المعادلة التي تمثل التحلل المائي للملح بين الأحماض والقواعد القوية من إذابة كلورات البوتاسيوم في الماء هي:
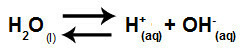
المعادلة الكيميائية للتحلل المائي لكلورات البوتاسيوم
بي ديوغو لوبيز دياس
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
DAYS ، ديوغو لوبيز. "التحلل المائي الملحي بين الأحماض القوية والقواعد القوية" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm. تم الوصول إليه في 28 يونيو 2021.
كيمياء

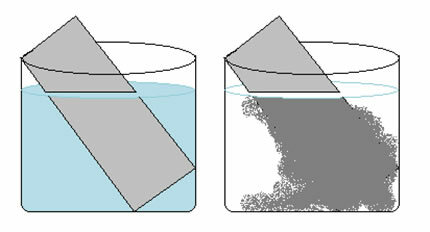
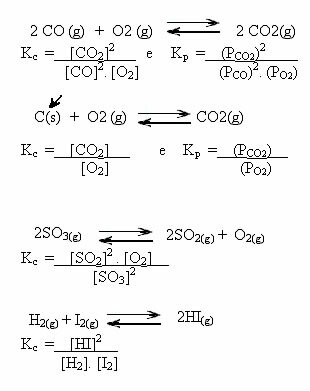
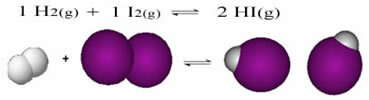
اختبر معلوماتك وتعلم المزيد مع هذه القائمة من التمارين التي تم حلها على الموازين الكيميائية. من خلال هذه المادة ، ستكون قادرًا على فهم كيفية عمل ثوابت التوازن (Kp و Kc و Ki) بشكل أفضل ، وتحول التوازن ، ودرجة الحموضة و pOH ، وكذلك التوازن في ما يسمى بالحلول العازلة.