Текст Реакції додавання показав, що такі типи органічних реакцій названі таким чином, оскільки до органічної молекули додається реагент, розриваючи зв’язки між вуглецями. У цьому тексті був показаний випадок алкенів, тут ми вже розглянемо, як це відбувається з алкінами, або тобто з тими вуглеводнями (утвореними лише атомами вуглецю та водню), які мають зв’язок потрійний.
Вразливою точкою алкінів є саме потрійний зв’язок, де зв’язки типу pi (π) можуть розриватися (додавання частковий) або двічі (повне додавання) і дають початок, відповідно, новим сполукам з подвійними (алкени) або одинарними зв’язками (алкани).
Давайте розглянемо випадки реакцій приєднання в алкінах:
1. Додавання водню або гідрування:
У цьому випадку молекула Н2 додається до алкіну за допомогою каталізатора, яким зазвичай є порошкоподібний нікель (Ni), платина (Pt) або паладій (Pd). Через необхідність використання каталізатора ця реакція також називається каталітичне гідрування і це відбувається поетапно: на першій стадії ви отримуєте алкен, а на другій стадії, яка відбувається повільніше, ви отримуєте алкан.
Якщо каталізатор, що використовується, є сильним, таким як нікель і платина, реакція безпосередньо утворює алкан. Паладій, змішаний з BaSO4 він є слабким каталізатором і виробляє алкен. Також можна використовувати частковий інгібітор каталізатора, щоб досягти лише алкену. Ця реакція також відбувається під високим тиском і температурою.
Далі ми додаємо водень до етану, отримуючи етилен, а потім етан:

2. Додавання галогенів або галогенування:
Пі-зв'язок алкіну розривається і до молекули додають два атоми галогену (елементи з сімейства 17A Періодичної системи, найбільш використовувані: Cl2 та Br2), утворюючи віталіновий дигалід, що означає, що два атоми галогену зв’язані з сусідніми атомами вуглецю. Реакція може продовжуватися, розриваючи інший пі-зв’язок і додаючи до молекули ще два атоми галогену.
У наведеному нижче прикладі ми маємо такий вид доповнення до хабара:
КлCl ClКл
││ ││
H ─C ≡ C CH3 + Кл2 → H ─ C ═ C CH3 + Кл2 → H ─ C ─ C CH3
││
КлКл
ТЕТРАГАЛЕТИ АЛЬКІНО ДІ-ГАЛЕТ
3. Додавання галогенідів водню (галогенгідриди або гідрогалогенування):
Тут до алкіну додається галогенід водню, також може мати місце часткове та повне додавання. Важливим аспектом цього типу реакції є те, що вона слідує за реакцією Правління Марковникова, тобто водень пов'язується з більш гідрованим вуглецем (з більшою кількістю атомів водню), а галоген - з менш гідрованим вуглецем.
При загальному гідрогалогенуванні утворюється гемічний дигалід, тобто сполука, яка має два атоми галогену, приєднані до одного вуглецю.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Дивитися:
HBr Hбр
││ ││
H ─C ≡ C CH3 + HBr → H ─ C ═ C CH3 + HBr → H ─ C ─ C CH3
││
Hбр
ГЕЛІЧНИЙ ДІ-ГАЛОГІД АЛЬЦІНОГАЛІДУ
Важливим прикладом цього типу реакції є реакція, яка відбувається, коли хлористий водень додають до етину, утворюючи хлоретен або монохлорид вінілу, який є мономером, що утворює полівінілхлоридний полімер, більш відомий за своїм скороченням ПВХ.
HClHКл
││ ││
H ─C ≡ C ─ H + HCl → H ─ C ═ C ─ H + HCl → H ─ C ─ C ─ H
││
HКл
ЕТИНОХЛОРОЕТЕН 1,1-ДИХЛОРОЕТАН
(ПВХ-мономер)
ПВХ - це речовина, яка широко використовується в промисловості для виготовлення різних виробів, таких як сандалі, пляшки з ліками, медичні вироби, пластикові штани для немовлят, сумки, дротяні покриття, іграшки, оббивка меблів, оббивка автомобілів, плащі, пластикове взуття, вінілові платівки, підлоги, пакувальні плівки, труби, що використовуються у водопровідних трубах та стічні води тощо
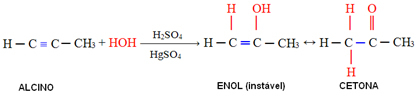
4. Додавання води (гідратація):
У цій реакції вода реагує з алкіном, спочатку утворюючи енол, який зазнає молекулярної перебудови і перетворюється на альдегід (у випадку алкінів, менших за ацетилен). Енол та альдегід залишаються в динамічній рівновазі з переважанням альдегіду. Це випадок Динамічна конституцикональна ізомерія або таутомерія.
Приклад:

У випадку алкінів, більших за ацетилен, дотримуються правила Марковникова, і енол дає кетон:
Дженніфер Фогача
Закінчив хімію