Реакції сульфонування в алканах вони є реакції органічного заміщення, здійснене з метою виробництва сульфокислоти (органічні сполуки, що мають SO-групу3Н, приєднаний до атома вуглецю або до вуглецевого ланцюга) та води (H2О).
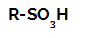
Структурна формула сульфонової кислоти
Для проведення реакції сульфування на алкани, ми повинні змішати алкан (сполуку, утворену вуглецевим ланцюгом, насиченим лише атомами вуглецю та водню) та сірчана кислота (H2ТІЛЬКИ4) концентровані, піддані нагріванню (∆).
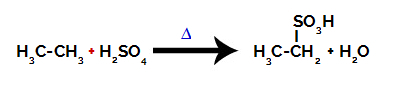
Хімічне рівняння, що представляє сульфування двовуглецевого алкану
Принципи реакції сульфонування в алканах
Як от реакція сульфонування алкану це реакція заміщення, ми маємо в ній обмін між меншими компонентами електронегативність реагентів, тобто між алканом і сірчаною кислотою. Алкан має водень і сірчану кислоту - сульфонову групу.
Нижче ми маємо поетапний механізм a реакція сульфування в алканах. Як приклад ми використаємо найпростіший алкан, метан (СН4):
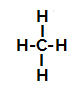
Структурна формула метану
1-й крок: Порушення зв’язку між гідроксилом (OH) та сіркою (S) у сірчаній кислоті.
Кожна гідроксильна група, присутня в сірчаній кислоті, характеризується тим, що є більш електронегативною. При нагріванні під час реакції тенденція полягає в тому, що зв'язок між гідроксильною групою та сіркою порушується:
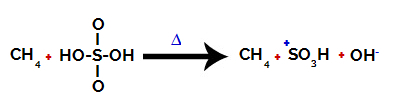
Порушення зв'язку між сіркою та гідроксилом
Однак розрив зв'язку всіх гідроксилів не відбувається через електронну перебудову в структурі. Потім отримують гідроксид-аніон (ОН).-) і сульфоновий катіон.
2-й крок: Атака гідроксильної групи на молекулу алкану.
Потім гідроксильна група (OH-) здійснює атаку на алкан, внаслідок чого зв’язок між вуглецем та воднем (який є більш крихким через різницю в електронегативності між ними) порушується.
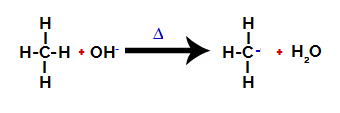
Розрив зв'язку між вуглецем та воднем в алкані
Примітка: Порушення зв'язку між вуглецем та воднем завжди найчастіше відбуватиметься на вуглеці з меншою електронною щільністю або зарядом. Чим менше вуглеводнів має вуглець або чим більше приєднаних до нього груп, тим менша його електронна щільність. Отже, маємо:
Третинний вуглець
Після розриву зв'язку алкан стає вуглецем з дефіцитом електронів (карбокатіон). Гідроксидна група (OH)-) взаємодіє з виділеним воднем і утворює молекулу води.
3-й крок: Атака утвореного радикала на сульфонову групу.
Нарешті, сульфонову групу атакує решта алкану, утворюючи сульфонову кислоту.
Не зупиняйтесь зараз... Після реклами є ще щось;)
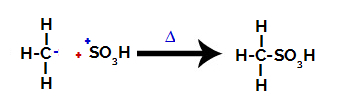
Структури, що взаємодіють і утворюють сульфонову кислоту
Приклади рівнянь, що представляють реакції сульфування в алканах
1-й приклад: Сульфування пропану.
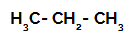
Структурна формула пропану
Пропан має два основних вуглецю і один вторинний вуглець, які мають різні заряди, оскільки вони зв’язані з різною кількістю водню. Оскільки вуглець більш електронегативний, ніж водень, ці вуглеці мають різну густину електронів.
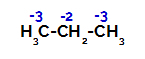
Розподіл зарядів на кожен атом вуглецю пропану
На первинних вуглецях заряд дорівнює -3 (оскільки він зв’язаний з трьома воднями), а на вторинному вуглеці заряд становить -2 (оскільки зв’язаний з двома воднями). Таким чином, відбудеться розрив зв’язку між вуглецем та воднем, іноді у вуглецю 1 (однієї молекули), іноді у вуглецю 2 (іншої молекули).
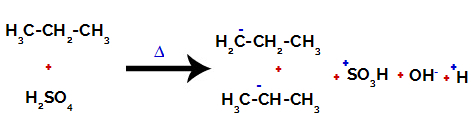
Розрив зв’язку між вуглецем та воднем на різних вуглецях
Після розривів зв’язків як у сірчаній кислоті, так і в алкані відбувається утворення продукти із заміщенням водню на вуглеці 1 сульфоновою групою, і те саме відбувається на вуглеці 2.
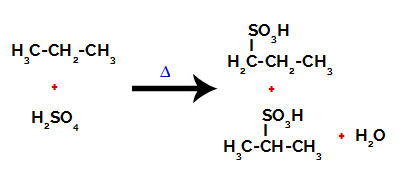
Продукти, що утворюються в результаті сульфування пропану
2-й приклад: Сульфонування 2-метил-бутану.

Структурна формула 2-метил-бутану
2-метил-бутан має три основних вуглецю, вторинний вугілля та третинний вуглець, які мають різні заряди і, як наслідок, різні електронні густини, як це видно з наступної структури:
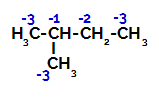
Розподіл електронних зарядів у 2-метил-бутані
Отже, у 2-метил-бутану є кілька можливостей розриву зв'язку між вуглецем та воднем, що може відбуватися на вуглеці 1 (молекули), вуглеці 2 (іншої молекули), вуглеці 3 або вуглеці 4. Однак варто зазначити, що порушення при вуглецевому номері 2 є більш поширеними.
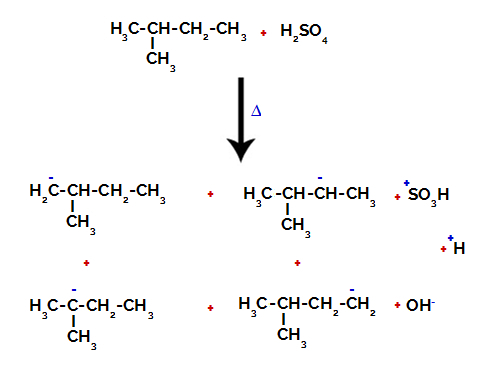
Розрив зв’язку між вуглецем та воднем на різних вуглецях
Після розриву зв'язків, як у сірчаній кислоті, так і в алкані, утворюється продукти із заміною водню на вуглеці 1 сульфоновою групою, і те саме відбувається на вуглець 2.

Продукти, що утворюються в результаті сульфування 2-метил-бутану
Мені Діого Лопес Діас
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
ДНІ, Діоґо Лопес. «Реакції сульфонування в алканах»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm. Доступ 28 червня 2021 року.