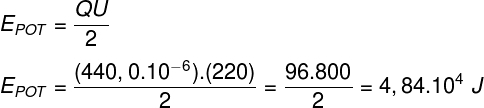Групова назва (Т) - метод концентрації розчинів, який відноситься до маси розчинена речовина з масою рішення. З цієї причини він завжди виражає кількість розчиненої речовини по відношенню до розчину, тобто, коли ми обчислюємо масовий титр, його результат відноситься до розчиненої речовини в розчині.
Маса розчину - це сума маси розчиненої речовини (м1) і масу розчинник (м2).
m = m1 + м2
Формула масового заголовка
Формула, що використовується для обчислення масивної назви:
Т = м1
м
Т = титр маси розчиненої речовини
м1 = маса розчиненої речовини
m = маса розчину
Т = м1
м1 + м2
м2 = маса розчинника
Одиниця масового заголовка
У розрахунках із заголовком маси ми завжди повинні використовувати маси розчиненої речовини, розчинника та розчину в одній одиниці. Отже, оскільки це відносини між масами, одиниці поділяються; найближчим часом масова назва не має одиниці виміру.
Відсоток від загальної назви
З наведеного в заголовку значення розчину ми можемо розрахувати відсоток розчиненої речовини, а також розчинника, використовуючи наступну формулу:
P = T. 100
Р = відсоток
T = основна назва
Примітно, що ми завжди обчислюємо відсоток від основного заголовка. Безпосередньо визначається лише відсоток розчиненої речовини. Для визначення масового відсотка розчинника в розчині необхідно відняти від 100 відсоток, знайдений для розчиненої речовини:
Масовий відсоток розчинника = 100 - масовий відсоток розчиненої речовини
Приклади масових розрахунків заголовків
1-й приклад- (FO-Diamantine-MG) Скільки грамів води потрібно для приготування 20% -ного по масі розчину з використанням 80 г розчиненої речовини?
а) 400
б) 500
Не зупиняйтесь зараз... Після реклами є ще щось;)
в) 180
г) 320
д) 480
Дані, надані вправою:
Відсоток = 20%
Маса розчиненої речовини (м1) = 80г
водна маса (м2) = ?
Крок 1: перетворити заданий відсоток на заголовок.
P = T. 100
20 = Т. 100
Т = 20
100
Т = 0,2
Крок 2: використовуйте дані у формулі нижче, щоб визначити масу води.
Т = м1
м1 + м2
0,2 = 80
80 + м2
0,2. (80 + м2) = 80
16 + 0,2м2 = 80
0,2м2 = 80 – 16
м2 = 64
0,2
м2 = 320г
2-й приклад - (UFMS) Сахароза - це дуже розчинний вуглевод у воді; для насичення 0,5 л чистої води (d = 1,0 г / мл) при температурі 20 ° C потрібно 1000 г цього цукру. Приблизно яка концентрація цього розчину у відсотках (м / м)?
а) 50%.
б) 25%.
в) 78%.
г) 67%.
д) 90%.
Дані, надані вправою:
Відсоток =?
Маса розчиненої речовини (м1) = 1000 г.
Потік води (V2) = 0,5 л або 500 мл
Густина води (d2) = 1 г / мл
Крок 1: розрахувати масу розчинника, що використовується для приготування розчину, за формулою щільності.
d2 = м2
V2
1 = м2
500
м2 = 500г
Крок 2: використовуйте дані, наведені у формулі нижче, щоб визначити основний заголовок.
Т = м1
м1 + м2
Т = 1000
1000 + 500
Т = 1000
1000 + 500
Т = 1000
1500
T = 0,67 (приблизно)
Крок 3: обчислити відсоток від знайденого основного заголовка.
P = T. 100
Р = 0,67. 100
P = 67%
Мені Діого Лопес Діас
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
ДНІ, Діоґо Лопес. "Що таке масовий заголовок?"; Бразильська школа. Доступно: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-titulo-massa.htm. Доступ 28 червня 2021 року.