THE Електрохімія є розділом фізичної хімії, який вивчає реакції, в яких відбувається перенесення електронів (реакції окисно-відновного процесу) та його перетворення в електричну енергію, а також протилежний процес, тобто перетворення електричної енергії в енергію хімія.
Перший процес - це те, що відбувається в Батареї. Батареї - це пристрої, утворені двома електродами (додатним полюсом, який є катодом, і негативним полюсом, який є анодом), крім електроліту (провідного розчину). Електрони передаються зовнішнім провідником від анода до катода, утворюючи електричний струм, який використовується для включення якогось пристрою. Батареї складаються з декількох комірок, з'єднаних послідовно або паралельно.
Це спонтанний процес, і енергія подається до тих пір, поки хімічна реакція не вичерпається (як це відбувається з первинними елементами та акумуляторами, такими як суха комірка Лекланше та батарея лужний), або, у разі оборотних реакцій, може бути застосована різниця потенціалів і реакція зворотна, утворюючи знову реагенти та заряджаючи акумулятор, який готовий до використання знову (це стосується акумуляторів та вторинних батарей, таких як свинець, що використовується в автомобілях, та іон літію, що використовується в побутових приладах мобільні телефони).

Первинні елементи та батареї на передньому плані, а на другому - зарядка вторинних батарей (свинцю та іонів літію)
Не зупиняйтесь зараз... Після реклами є ще щось;)
Зворотний процес не є спонтанним і називається електроліз. Електроліз - це проходження електричного струму, що надходить від генератора, такого як елемент або батарея, через іонну рідину. Якщо рідина - це якась розплавлена речовина, ми маємо a магматичний електроліз, але якщо це водний розчин, ми маємо водний електроліз.
Пропускаючи електричний струм над рідким середовищем, генератор "витягує" електрони з позитивного полюса (анод - він протилежний акумулятора) електролізера і переносить їх на негативний полюс (катод), тобто катод зазнає редукції, а анод - окислення. Таким чином, електрична енергія, що подається генератором, перетворюється в окисно-відновну реакцію (хімічна енергія). Нижче наведена схема електролізу води:
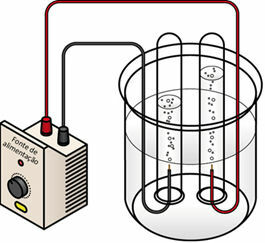
Схема електролізу води
Електроліз широко застосовується промислово при виробництві таких важливих речовин, як алюміній, газоподібний хлор, металевий натрій, а також для очищення або захисту різних металів, як при гальваніці або процесах гальваніки, які полягають у покритті якогось предмета металом, такого як сріблення, міднення, нікелювання, позолота та хромація; коли сталь покрита цинком, це називається цинкуванням.
У розділі Електрохімія на нашому веб-сайті ви знайдете докладнішу інформацію про всі аспекти, пов’язані з елементами та батареями, а також електролізом.
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. "Що таке електрохімія?"; Бразильська школа. Доступно: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletroquimica.htm. Доступ 27 червня 2021 року.
Хімія

Електроліз, розчини електролітів, електричний струм, реакції відновлення окиснення, спонтанний хімічний процес, хімічний процес неспонтанний, трансформатор, штучне перетворення, промисловість, лужні метали, лужноземельні ділянки, газоподібний водень, газ cl


