THE ебуліоскопія, один із чотирьох колігативні властивості, вивчає поведінку точки кипіння a розчинник при отриманні одного розчинена речовина енергонезалежні. Іншими колігативними властивостями є тоноскопія, кріоскопія і осмоскопія.
Примітка: Енергетична розчинена речовина - це будь-яка речовина, що має високий вміст Точка кипіння і низька температура плавлення і здатна розчинятися в певному розчиннику.
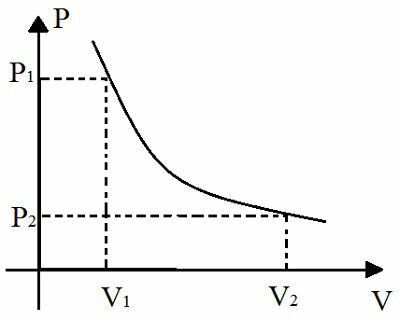
Взагалі кажучи, коли до розчинника додають нелетючу розчинену речовину, це ускладнює випаровування розчинника. Таким чином, для випаровування розчинника необхідна більш висока температура. В ебуліоскопія, це збільшення температури кипіння розчинника вивчається.
Ця складність, спричинена розчиненою речовиною при випаровуванні розчинника, тобто підвищенням температури кипіння розчинника, безпосередньо пов'язана з типом розчиненої речовини, яка присутня в розчині. Можливі типи розчиненої речовини:
Іонна розчинена речовина: при додаванні у воду, іонізувати або дисоціює, заселяючи розчин іонами. Приклади: сіль, основа, кислота.
молекулярна розчинена речовина: при додаванні у воду він не іонізується, зберігаючи молекулярну форму. Приклади: глюкоза, сахароза.
Чим більше кількість частинок у розчиннику, тим інтенсивніше ебуліоскопія, тобто чим вище температура кипіння розчинника. Таким чином, в іонних розчинах температура кипіння води, як правило, завжди вища, ніж температура кипіння молекулярних розчинів, якщо вони знаходяться в однаковій концентрації.
Формули, що використовуються в розрахунки ебуліоскопії
Для виконання розрахунків ебуліоскопія, маємо такі формули:
Формула для розрахунку зміни температури кипіння
Δte = t-t2
У цій формулі ми обчислюємо варіацію температури кипіння, віднімаючи температуру кипіння розчинника, існуючого в розчині, від температури кипіння чистого розчинника.
Примітка: Скорочення Δte також можна назвати підвищенням температури кипіння розчинника.
Формула для розрахунку підвищення температури кипіння за участю молальність
Δte = Ke. W
Це формула, яка застосовуватиметься, залежить від знання константи ебуліоскопії, яка пов’язана з розчинником, присутнім у розчині, та молярності (W). Кожна з цих змінних має певну формулу.
Корекційний коефіцієнт Ван-Гоффа (i) також може фігурувати у цій формулі, однак, лише якщо присутня нелетуча розчинена речовина є іонною.
Δte = Ke. W.i
Примітка: Для визначення Корекційний коефіцієнт Вант Гоффа, нам потрібна ступінь іонізації або дисоціації розчиненої речовини та кількість частинок (q), іонізованих або дисоційованих розчиненою речовиною, коли вона знаходиться у воді.
Формула для обчислення ебуліскопічної константи (Ke)
Ke = RT2
1000.Lv
У цій формулі ми маємо загальну газову константу (0,082), температуру (завжди працювала в кельвіні) і приховану теплоту випаровування.
Формула для розрахунку молярності (W)
W = м1
М1.m2
У цій формулі використовується маса розчиненої речовини (м1 - завжди працював у грамах) молярної маси розчиненої речовини (M1) і маси розчинника (м2 - завжди працював у кілограмах).
Не зупиняйтесь зараз... Після реклами є ще щось;)
Примітка: Зі знання формули молярності, якщо замінити W, присутній у формулі Δte, на відповідну формулу, ми отримаємо такий результат:
Δte = Ke.m1
М1.m2
Приклад застосування формул при розрахунку ебуліоскопії
1-й приклад - (Уеце) Слідом за французьким хіміком Франсуа-Марі Раулем (1830-1901), досліджуючи ебуліометричний ефект розчинів, студент хімії розчинив 90 г глюкози (С6H12О6) у 400 г води і нагріли ціле. Знаючи, що Ke у воді = 0,52 ºC / моль, через деякий час встановлена ним початкова температура кипіння становила: (Дані: Молярна маса глюкози = 180 г / моль)
а) 99,85 ° С.
б) 100,15 ° С.
в) 100,50 ° С.
г) 100,65 ° С.
Дані, надані вправою:
м1= 90 г;
м2 = 400 г або 0,4 кг (після ділення на 1000);
Ke = 0,52;
М1 = 180 г / моль;
t =? (початкова температура кипіння або температура кипіння розчинника в розчині).
Примітка: Температура кипіння води (т2) дорівнює 100 ОÇ.
Оскільки вправа забезпечила маси та константу ебуліоскопії, просто використовуйте дані у виразі нижче:
т-т2 = Ke.m1
М1.m2
t-100 = 0,52.90
180.0,4
t-100 = 46,8
72
t-100 = 0,65
t = 0,65 + 100
t = 100,65 ОÇ
2-й приклад - (Uece) Хлорид кальцію (CaCl2) має широке промислове застосування в холодильних системах, у виробництві цементу, у коагуляції молока для виробництва сиру та чудово використовується як регулятор вологи. Розчин хлориду кальцію, що використовується в промислових цілях, має молярність 2 і температуру кипіння 103,016 ° С під тиском 1 атм. Знаючи, що константа ебуліоскопії води становить 0,52 ° С, її видимий ступінь іонної дисоціації становить:
а) 80%.
б) 85%.
в) 90%.
г) 95%.
Дані, надані вправою:
- Ke = 0,52;
- Ш = 2 родимки;
- t = 103,016 (початкова температура кипіння або температура кипіння розчинника в розчині).
Примітка: Температура кипіння води (т2) дорівнює 100 ОÇ.
Оскільки вправа надавала дані про ебуліоскопію, такі як Ke та молальність, очевидно, що ми повинні використовувати наступну формулу для ебуліоскопії:
Δte = Ke. W
Однак, оскільки вправа вимагає ступеня дисоціації, ми повинні опрацювати наведену вище формулу з коефіцієнтом коригування Вант Гофа (i):
Δte = Ke. W.i
Крім того, для обчислення ступеня вам потрібно буде замінити i на його вираз, який дорівнює 1 + α. (Q-1):
т-т2 = Ке. Ш. [1 + α. (Q-1)]
103,016-100 = 0,52.2.[1+ α.(3-1)]
3,016 = 1,04.[1+ 2 α]
3,016 = 1,04 + 2,08α
3,016 – 1,04 = 2,08α
1,976 = 2,08α
1,976 = α
2,08
α = 0,95
Нарешті, просто помножте знайдене значення на 100, щоб визначити відсоток:
α = 0,95.100
α = 95%
Мені Діого Лопес Діас