THE ентальпія утворення, також називається стандартна ентальпія формації, або стандартна теплота формування, - це розрахунок теплоти, що виділяється або поглинається при утворенні 1 моля речовини з простих речовин, у стандартному стані.
Неможливо розрахувати абсолютне значення ентальпій кожної речовини, але можна обчислити варіацію ентальпії, яка виникає в реакції, за допомогою калориметра.
Необхідно пам'ятати про це було погоджено прийняти значення ентальпії, рівне нулю, для простих речовин у стандартному стані. Таким чином, якщо ми хочемо з’ясувати, що таке ентальпія утворення речовини, нам потрібно лише знати значення ентальпії реакції її утворення з простих речовин.
Наприклад, ми хочемо знайти ентальпію 18 грам води, що відповідає 1 моль, оскільки її молярна маса становить 18 г / моль. Для цього нам спочатку потрібна реакція на утворення води з простих речовин, як показано нижче:
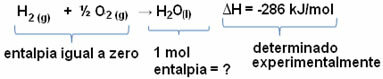
Зауважимо, що значення зміни ентальпії, що відбулося в цій реакції, було експериментально визначено за допомогою калориметра і дорівнює -286 кДж / моль.
Формула, яка обчислює цю зміну ентальпії (ΔH):
ΔH = HПродукти - Ч.Реагенти
Таким чином, оскільки ми вже знаємо значення ΔH і що ентальпія реагентів дорівнює нулю (оскільки вони є простими речовинами у стандартному стані), то тоді можна зробити висновок що значення ентальпії 1 моль води дорівнює зміні ентальпії реакції утворення, оскільки це єдиний продукт цієї реакції, як показано нижче:
ΔH = HПродукти - Ч.Реагенти
-286 кДж / моль = HH2O - (HН2 + H1/2 О2)
-286 кДж / моль = HH2O - 0
HH2O = - 286 кДж / моль
Не зупиняйтесь зараз... Після реклами є ще щось;)
Таким чином, цей тип ентальпії, досягнутий завдяки ентальпії простих речовин у стандартному стані, є стандартна ентальпія пласта (ΔH0).
Зараз існує багато речовин, які не утворюються безпосередньо в результаті однієї реакції, наприклад вода. У таких випадках ентальпію утворення можна розрахувати на основі варіації ентальпії реакції.
Наприклад, NH4Cl утворюється за такою реакцією:
NH3 + HCl → NH4Кл ΔH = -176 кДж / моль
Зауважте, що жоден з реагентів не є простою речовиною, тому ми не можемо призначити їм нульову ентальпію. Нам потрібно знати ентальпії утворення кожного з реагентів, оскільки вони утворюються в результаті реакцій між простими речовинами:
NH3: ΔH = -46 кДж / моль
HCl: ΔH = -92,4 кДж / моль
Додавши ці дві ентальпії разом, ми отримуємо значення ентальпії реагентів і можемо знайти ентальпію NH4Cl:
HР. = HNH3 + HHCl
HР. = (-46 + (-92,4) кДж / моль)
HР. = -138,4 кДж / моль
Підставивши у формулу:
ΔH = HПродукти - Ч.Реагенти
-176 = НNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 кДж / моль
У цьому випадку ми безпосередньо підсумували значення ентальпій утворення реагентів, оскільки коефіцієнт реакції становив лише 1 моль. Однак, якщо в інших реакціях кількість родимок відрізняється, спочатку необхідно помножити ентальпію утворення реагенту на кількість родимок.
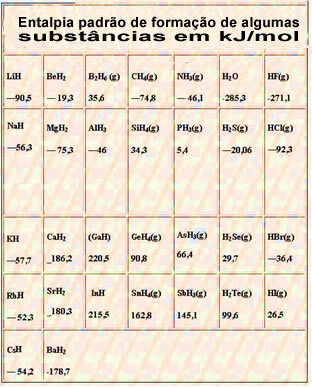
Нижче наведена таблиця зі стандартною ентальпією утворення деяких речовин при 25 ° C і 1 атм:
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. "Ентальпія формації"; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm. Доступ 27 червня 2021 року.


