Ми можемо це відзначити всякий раз, коли ми збільшуємо концентрацію одного або всіх реагентів, що беруть участь у хімічній реакції, відбувається збільшення швидкості її розвитку, тобто швидкості реакції.
Вірно і навпаки. Наприклад, в даний час рекомендується використовувати алкогольний гель замість звичайного алкоголю, оскільки є менший ризик його згоряння і, таким чином, уникнення нещасних випадків. Звичайний рідкий алкоголь насправді є сумішшю алкоголю та води, а гелевий спирт містить меншу кількість спирту. Отже, коли концентрація одного з реагентів горіння знижується, у випадку алкоголю реакція протікає повільніше. З іншого боку, чим чистіший спирт, тим швидша реакція горіння.

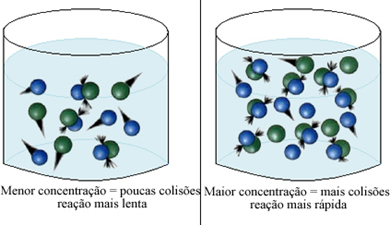
Як зазначено в тексті Умови виникнення хімічних реакцій, однією з умов реакції є: ефективне зіткнення між частинками. Таким чином, збільшення концентрації реагентів дозволяє мати більшу кількість частинок або молекул, що знаходяться в одному просторі. Це збільшує кількість зіткнень між ними, а також збільшує ймовірність ефективних зіткнень, що призведуть до реакції. В результаті реакція проходить швидше.
Щоб побачити це, подумайте про такий приклад: коли у нас горить вугілля і ми хочемо, щоб це горіння швидше оброблялося, ми продуваємо або роздуваємо вугілля? Чому це працює?
Ну, одним із реагентів у цій реакції горіння є кисень у повітрі. Коли ми трясемось, повітряний струм видаляє золу, що утворюється під час горіння, і це полегшує контакт кисню з вуглинкою. Таким чином ми збільшуємо контакт між реагентами і прискорюємо реакцію горіння.
Коротко, ми маємо:

При роботі з газами одним із способів збільшення концентрації реагентів є знизити тиск. Коли ми це робимо, ми зменшуємо об’єм, і, отже, відбувається збільшення концентрації реагенту.

Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm

