Уявіть, що ви додаєте 10 г кухонної солі (хлорид натрію - NaCl) у склянку зі 100 г води при 20ºC. Змішавши, ви бачите, що сіль повністю розчинилася, тому ви вирішили додати ще більше солі. У якийсь момент ви більше не зможете розчинити сіль у такій кількості води, і будь-яка додана сіль опуститься на дно склянки, як би ви не намагалися її змішати.
Коли це трапляється, ми говоримо, що рішення є насичений і що коефіцієнт розчинності. Отже, ми можемо визначити коефіцієнт розчинності наступним чином:
“Коефіцієнт розчинності - це максимальна кількість розчиненої речовини, яка солюбілізована в даній кількості розчинника, при певній температурі ».
Наприклад, коефіцієнт розчинності солі у воді дорівнює 36 г NaCl / 100 г води при 20 ° С. Не можна розчинити зайвий грам солі в цій кількості води і при цій температурі, як коефіцієнт розчинності є специфічним для кожної речовини. Якщо ми замінимо розчинену речовину, наприклад, замінивши кухонну сіль NH4Cl, цей коефіцієнт розчинності дорівнює 37,2 г у 100 г води при 20 ° C.
Крім того, одна і та ж речовина має різну розчинність у різних розчинниках. Хоча сіль розчинна у воді, вона практично не розчиняється в ацетоні або етилацетаті (розчинник, який використовується для видалення глазурі).
Інший момент полягає в тому, що щоразу, коли згадується коефіцієнт розчинності розчиненої речовини в даній кількості розчинника, також необхідно вказати температуру, оскільки це заважаючий фактор. Наприклад, якщо взяти 100 г води при 20 ° C і додати 40 г солі, 36 г розчиниться, а 4 г утворять осад. Але якщо взяти цей розчин для нагрівання, ми побачимо, що 4 г розчиняться у міру підвищення температури.
Це показує нам, що одна і та ж розчинена речовина, розчинена в одній кількості розчинника, має різні коефіцієнти розчинності при підвищенні температури.
Дивіться приклад нижче:
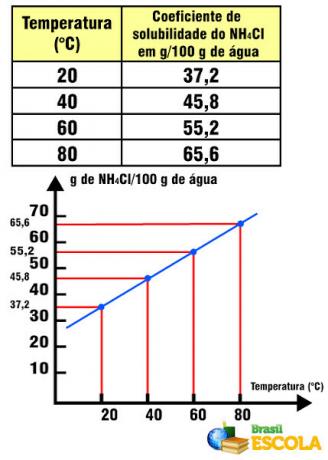
Коефіцієнт розчинності NH4Cl по відношенню до температури
Зауважимо, що в цьому випадку коефіцієнт розчинності NH4Cl збільшується з підвищенням температури. Це трапляється з більшістю солей у воді. Однак бувають ситуації, коли коефіцієнт розчинності зменшується із збільшенням температури, як у випадку Ce2(ТІЛЬКИ4)3. Бувають також випадки, коли не спостерігається такої помітної мінливості коефіцієнта розчинності, як це відбувається з кухонною сіллю. Дивіться це в тексті Графіки кривих розчинності.
Можливо, ми також можемо у певних конкретних ситуаціях розчинити кількість розчиненої речовини в розчиннику, більшу за коефіцієнт його розчинності, отримуючи, таким чином, т.зв. пересичений розчин. Наприклад, уявіть, що розчин утворюється зі 100 г води при 20 ° С і 40 г кухонної солі (з 36 г розчиненого і 4 г осадженого), нагрівають до досягнення температури, при якій всі розчинені речовини розчиніть себе. Потім цей розчин залишають відпочивати, щоб він охолоджувався до досягнення кімнатної температури, яка становить близько 20 ° C.
Якщо в розчині немає порушень, зайва розчинена речовина залишиться розчиненою, утворюючи таким чином перенасичений розчин. Однак цей тип розчину дуже нестабільний, і будь-який раптовий рух може призвести до кристалізації кількості вище коефіцієнта розчинності для цієї температури. Таким чином, рішення, яке було перенасичений стане насичене фоном тіло.
Останній випадок - ненасичений розчин, тобто коли кількість розчиненої розчиненої речовини менше значення коефіцієнта розчинності. Прикладом є розчинення 10 г NaCl у 100 г води при 20 ° С.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm
