THE ентальпія (H) його можна визначити як енергетичний вміст кожного матеріалу або як загальну енергію системи. Однак на практиці неможливо визначити ентальпію речовини. Отже, те, що зазвичай вимірюється, - це варіація ентальпії 

Тут ми проаналізуємо варіацію ентальпії в екзотермічних реакціях (слово «екзо» походить від грецької мови та означає «вийти, вийти, вийти»), це ті реакції, в яких відбувається тепловиділення. У повсякденному житті існує безліч прикладів таких реакцій, таких як горіння та суміш негашеного вапна з водою.
У цих випадках варіація ентальпії 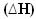 буде точно такою кількістю теплоти, що виділяється, заданою величиною кінцевої ентальпії мінус початкова ентальпія (Hf - Ч.i), або, оскільки це реакція, значення ентальпії продуктів мінус значення реагентів (HP - Ч.Р.).
буде точно такою кількістю теплоти, що виділяється, заданою величиною кінцевої ентальпії мінус початкова ентальпія (Hf - Ч.i), або, оскільки це реакція, значення ентальпії продуктів мінус значення реагентів (HP - Ч.Р.).
У міру виділення тепла енергія втрачається. Таким чином, загальна енергія системи зменшується, так що ентальпія продуктів завжди буде нижче, ніж реагентів, тому варіація ентальпії в екзотермічних реакціях завжди буде негативною, меншою ніж нуль 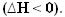
Враховуючи загальну екзотермічну реакцію:
| A → B + тепло |
Це можна виразити за допомогою діаграми ентальпії, як показано нижче:
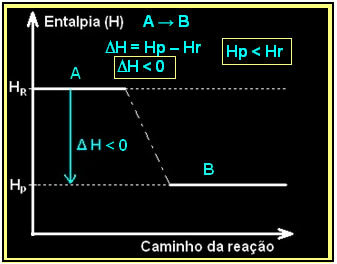
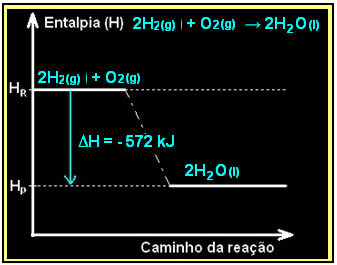
Спалювання газоподібного водню з утворенням рідкої води відбувається з виділенням енергії. Значення варіації ентальпії системи в цій реакції визначається:
2 год2 (г) + O2 (г) → 2Н2О(1)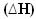 = - 572 кДж
= - 572 кДж
Ваша схема буде представлена наступним чином:
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm
