THE окислення і скорочення це реакції, які виникають, коли є a перенесення електронів між хімічними видами. Це протилежні реакції: при окисненні відбувається втрата електронів, а при відновленні відбувається приєднання електронів.
Ці процеси відбуваються одночасно, тому що коли речовина віддає електрони іншій, воно окислюється, а речовина, яка отримує електрони, зазнає відновлення.
Коли речовина окислюється, це призводить до відновлення інших видів, звідси і назва відновника. Подібним чином одна речовина відновлюється внаслідок окислення іншої і тому є окислювачем.
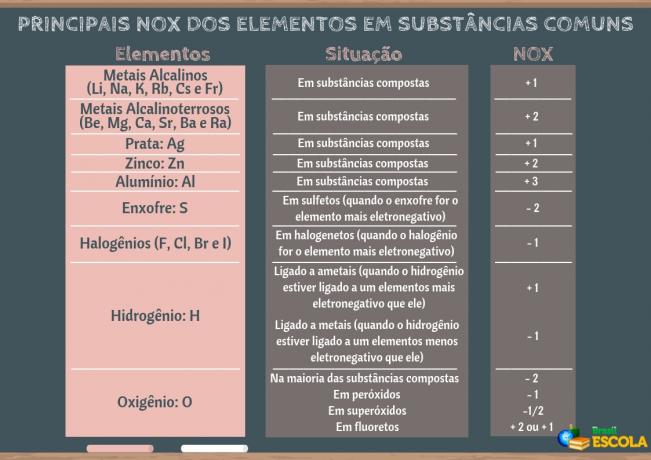
Реакції окислення та відновлення демонструються зміною ступеня окислення (nox) задіяних видів.
Загалом, реакцію, яка представляє собою окиснення та відновлення, можна представити так:
А + Б+ → А+ + Б
Де,
A: речовина, яка окислюється, втрачає електрони, збільшує своє значення і є відновником.
B: речовина, яка зазнає відновлення, отримує електрони, зменшує окиснення та є окислювачем.
Приклади окиснення і відновлення
Дивіться наступне зображення для прикладу окисно-відновного хімічного рівняння.
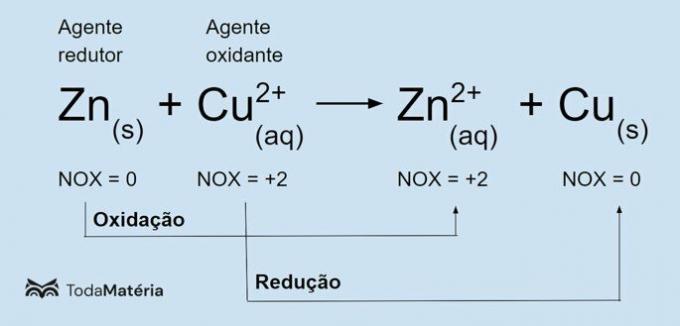
Металевий цинк зазнає окислення і викликає відновлення міді, тому він є відновником. Його ступінь окислення (nox) зростає від 0 до +2, оскільки він втрачає 2 електрони.
Іон міді (Cu2+) піддається відновленню та спричиняє окислення міді, тому є окислювачем. Її ступінь окислення (nox) зменшується від +2 до 0, тому що вона отримує 2 електрони і стає металевою міддю, яка є електрично нейтральною.
Інші приклади окисно-відновних реакцій у повсякденному житті:
спалювання метану
CH4(g) + 2О2(g) → CO2(g) + 2H2О(v)
Фотосинтез
6CO2(g) + 6Н2О(v) → C6Х12О6 (тут) + 6О2(g)
корозія заліза
2Fe(s) + 3/4O2(g) + 3 години2О(v) → 2Fe (OH)3(и) (іржа Fe2О3.3H2О)
Дізнайтеся більше про ступінь окислення (nox).
Як відбуваються реакції окиснення і відновлення?
Рівняння окисно-відновної реакції за участю міді та цинку можна представити напівреакціями, як показано нижче.
- напівреакція окислення: Зн0(s) → 2e- + Zn2+(тут)
- Напівреакція скорочення: зад2+(тут) + 2е- → зад0(s)
- глобальне рівняння: Зн0(s) + дупа2+(тут) → Zn2+(тут) + дупа0(s)
Цей перенос електрона в окислювально-відновній реакції відбувається відповідно до відновного потенціалу задіяних видів. Компонент з найнижчим потенціалом відновлення має тенденцію віддавати електрони, тоді як компонент з найвищим потенціалом їх одержує.
Наприклад, цинк має відновний потенціал -0,76 В, тоді як мідь має відновний потенціал +0,34 В. Таким чином, цинк, оскільки він має менший потенціал відновлення, є кращим відновником і сприяє відновленню мідь, яка має вищий потенціал відновлення і, отже, отримує електрони та викликає окислення цинку.
Читайте також про окисно-відновні реакції.
Вправи на окиснення і відновлення
Використовуйте наступні запитання, щоб перевірити свої знання про те, що ви дізналися з цього тексту.
питання 1
Щодо реакцій окислення і відновлення правильно стверджувати, що
a) Збільшення NOx хімічного виду вказує на те, що воно зазнало зменшення.
б) Речовина, яка втрачає електрони, піддається окисленню і є окисником.
в) В окисно-відновних реакціях відбувається перенесення електронів.
г) Речовина, яка отримує електрони, відновлюється і є відновником.
e) Зменшення NOx хімічної речовини вказує на те, що вона зазнала окислення.
Правильний варіант: в) В окиснювально-відновних реакціях відбувається перенесення електронів.
В окисно-відновних реакціях відбувається перенесення електронів.
Речовина, яка отримує електрони, піддається відновленню і є окислювачем. Зменшення NOx хімічного виду вказує на те, що воно було зменшено.
Речовина, яка втрачає електрони, піддається окисленню і є відновником. Збільшення NOX хімічної речовини вказує на те, що вона зазнала окислення.
питання 2
Приклади окисно-відновних реакцій у повсякденному житті КРІМ
а) Корозія
б) горіння
в) Фотосинтез
г) Нейтралізація
Неправильна альтернатива: d) Нейтралізація.
Реакція нейтралізації - це реакція, яка відбувається між кислотою та основою, в результаті чого утворюються сіль і вода. Наприклад:
NaOH + HCl → NaCl + H2О
Приклади окисно-відновної реакції:
спалювання метану
CH4(g) + 2О2(g) → CO2(g) + 2H2О(v)
Фотосинтез
6CO2(g) + 6Н2О(v) → C6Х12О6 (тут) + 6О2(g)
корозія заліза
2Fe(s) + 3/4O2(g) + 3 години2О(v) → 2Fe (OH)3(и)
питання 3
Зверніть увагу на наведені нижче окислювально-відновні реакції та вкажіть, які є окиснювачами та відновниками.
я Zn0(s) + дупа2+(тут) → Zn2+(тут) + дупа0(s)
II. дупа2+(тут) + H2(g) → 2H+(тут) + дупа(s)
III. Zn(s) + 2H+(тут) → Zn2+(тут) + H2(g)
Відповідь:
В окисно-відновній реакції той, що піддається окисленню, є відновником, а той, що піддається відновленню, є окислювачем.
я Zn0(s) + дупа2+(тут) → Zn2+(тут) + дупа0(s)
Окисник: мідь (Cu)
Відновник: цинк (Zn)
II. дупа2+(тут) + H2(g) → 2H+(тут) + дупа(s)
Окисник: мідь (Cu)
Відновник: водень (H)
III. Zn(s) + 2H+(тут) → Zn2+(тут) + H2(g)
Окисник: водень (H)
Відновник: цинк (Zn)
Отримайте більше знань зі змістом:
- Що таке стеки?
- електрохімії
- Електроліз
Бібліографічні посилання
ФОНСЕКА, М. Р. М Хімія, 2. 1. вид. Сан-Паулу: Аттика, 2013.
САНТОС, В.Л.П.; МОЛ, Г.С. Громадянська хімія, 3. 2. вид. Сан-Паулу: Editora AJS, 2013.
УСБЕРКО, Дж. Підключіть хімію, 2: хімія. - 2. вид. Сан-Паулу: Saraiva, 2014.