THE хром, атомний номер 24, є перехідним металом, що знаходиться в групі 6 Періодичної системи. Його колір сіруватий, але це також дуже блискучий метал. Він існує в основному в ступенях окислення +2, +3 і +6 і має властивість, що всі його сполуки забарвлені. Недарма його назва походить від грец кольоровість, що означає колір.
Цей елемент отримують через хроміт і широко використовуються в металургійній промисловості, у виробництві нержавіючої сталі та інших спеціальних сплавів. Хром також може бути нанесений гальванічним покриттям на об’єкти з ефектом, відомим як хромування, що гарантує, крім краси, велику хімічну стійкість. Сполуки хрому також використовуються в пігментах і фарбах, крім вогнетривких матеріалів.
Читайте також: Гафній — перехідний метал, який має властивості, подібні до цирконію
chrome резюме
Хром - сіруватий, блискучий метал, який відкриває групу 6 Періодична таблиця.
Він дуже стійкий до корозії та хімічного впливу при кімнатній температурі.
В основному він має ступені окислення +2, +3 і +6.
Всі його сполуки мають колір.
Його можна отримати з хроміту, FeCr2THE4.
Його в основному експлуатує металургійна промисловість, яка використовує його у виробництві нержавіюча сталь.
Його відкрив у 1797 році француз Луї Ніколя Воклен.
[pullicity_omnia]
властивості хрому
Символ: кр.
Атомний номер: 24.
Атомна маса: 51,9961 ц.у.с.
Електронегативність: 1,66.
Точка злиття: 1907°C.
Точка кипіння: 2671°C.
Щільність: 7,15 г.см-3 (при 20°C).
Електронна конфігурація: [Повітря] 4с1 3d5.
Хімічна серія: група 6, мetais переходу.
характеристики хрому
Хром, атомний номер 24, це a метал сірого кольору, твердий і глянсовий. При кімнатній температурі він добре протистоїть хімічним атакам, наприклад, від кислотних або основних розчинів, за винятком HCl і H2ТІЛЬКИ4 розведений. Однак при більш високих температурах хром стає набагато більш реакційноздатним, легко окислюється О2, і поєднується з галогенами та більшістю неметалів.
У розчині сполуки хрому, як правило, мають ступінь окиснення +6, +3 і +2. Насправді цікавою особливістю є те всі сполуки хрому кольорові, наприклад, дихромат калій, К2кр2THE7, який помаранчевий, і хромат калію, K2CrO4, який жовтий.
Цікавий факт про хром його електронна конфігурація не відповідає очікуваній схемі. роблячи свій електронний розподіл, очікується, що це буде [Ar] 4s2 3d4, однак розрахунки енергії та стабільності показують, що конфігурація [Ar] 4s1 3d5 він більш стабільний. Це можна пояснити тим, що Правило Хунда.
Відповідно до цього правила, чим більше число електрони при рівних (або паралельних) спінах на неповній орбіталі, тим менше енергія атом, тобто тим більша стабільність. Подивіться на зображення нижче:
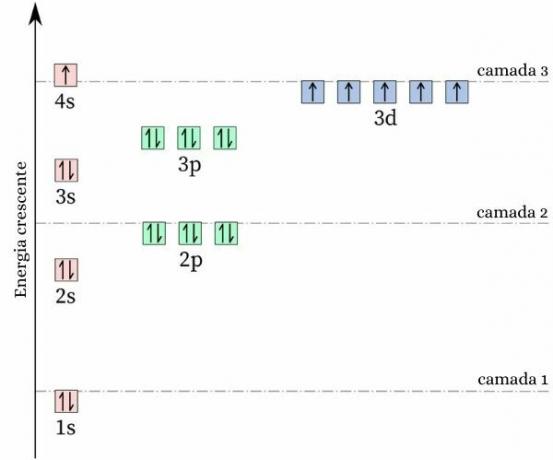
Якби хром прийняв конфігурацію 4s2 3d4, на орбіталі 4s будуть представлені електрони з протилежним спіном (↑↓), що збільшило б відштовхування, зрештою, було б два заряди одного знака, які поділяють одну орбіталі.
Прийнявши конфігурацію 4s1 3d5, хром утримує більшу кількість електронів з однаковим спіном, без наявності електронів, які мають ту саму орбіталь (як показано на попередньому зображенні), що зменшує його енергію та гарантує більшу стабільність.
Дивіться також: Ванадій — хімічний елемент, розчини якого також мають різні кольори
Де можна знайти хром?
хром - це десятий за поширеністю елемент на землі. Хоча є кілька мінералів, у складі яких є хром, хроміт, FeCr2THE4, є найважливішим мінералом хрому, який найбільш широко використовується в комерційних цілях.

Важливо підкреслити, що країни з найбільшими запасами хрому є:
Південна Африка;
Казахстан;
Індія;
Туреччина.
THE Бразилія є єдиним виробником хрому на всьому американському континенті, але володіє лише 0,11% світових запасів. Резерви розподіляються в основному в наступних штатах:
Байя;
амапа;
Мінас-Жерайс.
Отримання хрому

THE виробляється металевий хром через з хроміту. У цьому випадку мінерал розплавляють с карбонат натрію, At2CO3, у присутності повітря, утворюючи хромат натрію та оксид заліза III:
4 FeCr2THE4 + 8 дюймів2CO3 + 7 О2 → 8 дюймів2CrO4 + 2 Fe2THE3 + 8 CO2
Звідти витяг здійснюється с Вода, оскільки Na2CrO4 розчиняється у воді, а Fe2THE3 ні. Потім середовище підкислюють H2ТІЛЬКИ4, що дозволяє кристалізувати хромат натрію. на2CrO4 відновлюється до оксиду хрому III за допомогою вуглець при високій температурі:
В2CrO4 + 2 С → Кр2THE3 + увімкнено2CO3 + CO
Металевий хром отримують тоді, коли алюміній використовується як відновник, також при високій температурі:
кр2THE3 + 2 Al → Al2THE3 + 2 кр
chrome програми
THE промисловість металургійний є основним споживачем хрому, приблизно 80% всього виробленого хрому у формі хроміту або концентрату хрому.2THE3. Це пояснюється тим, що хром здатний утворювати ферохромний сплав, основний джерело для отримання нержавіюча сталь та інші спеціальні сплави.
Хром, який зазвичай становить 18% нержавіючої сталі, значно підвищує стійкість до окислення (корозії) та інших хімічних впливів на сталь. В інших спеціальних сплавах хром також відіграє важливу роль у підвищенні прокалюваності, твердості та в’язкості матеріалів.

THE вогнетривкої промисловості Він також є хорошим споживачем хрому, оскільки хроміт є відомим вогнетривким матеріалом, тобто матеріалом, здатним протистояти тепловому, хімічному та фізичному впливу, що виникає в промисловості. Хроміт, який використовується для виготовлення вогнетривкої цегли, дуже стійкий до руйнування при нагріванні.
вже хімічна промисловість прагне використовувати хром кількома способами:
як каталізатор;
як інгібітор корозії;
в хромуванні;
в пігментах;
у фарбувальних сумішах.
Добре відоме хромування, що полягає в утворенні захисного шару хрому над предметом, що захищає його від корозії. У цьому процесі хром наноситься на об’єкт, який потрібно хромувати електроліз сульфат хрому III, кр2(ЛИШЕ4)3, отриманий розчиненням Cr2THE3 в H2ТІЛЬКИ4.
Пігменти хрому дуже поширені, особливо з різними кольорами, які можна отримати з їх сполуками. При розчиненні гексагідрату хлориду хрому III CrCl3·6 ранку2О, виходить розчин фіолетового кольору. З іншого боку, при розчиненні сульфату хрому III Cr2(ЛИШЕ4)3, виходить зелений колір.
Розчин хлориду хрому II, CrCl2, синій, тоді як ацетат хрому II, Cr2(ОСП)4, є червоним твердим тілом. Оксид хрому II, CrO2, він чорний; хромат калію, K2CrO4, і жовтий; біхромат калію, К2кр2THE7, і апельсин; трихромат калію, K2кр3THE10, він червоний; і хром VI оксид, CrO3, також червоний.
Цікаво:Рубіни насправді є дорогоцінними каменями формули Al2THE3, які мають у своєму складі сліди хрому. Це також стосується смарагду, форми берилу, зелений колір якого є результатом невеликої кількості хрому.
Також знайте:Вольфрам — сіруватий метал, колір якого нагадує сталь
Відношення хрому до здоров’я
Біологічну роль відіграють дві ступені окиснення хрому. Подивимось далі.
→ Шестивалентний хром (кр6+)
Стосовно Кр6+, відомо, що може бути вважається канцерогенним, особливо при вдиханні або ковтанні у великих кількостях.
→ Тривалентний хром (кр3+)
Тривалентний хром був завжди розглянуто суттєвий елемент. Харчова добавка хрому в цій формі стала популярною для просування основних мікроелементів і як засіб для схуднення. Існує також дискусія про те, що введення тривалентного хрому було б цікавим для лікування цукровий діабет 2 типу, а також при гестаційному діабеті.
хоча, ставлять деякі автори ця істотність обговорюється. Лінія думки полягає в тому, що хром, доданий чи ні, не впливає на склад тіла, обмін речовин дає глюкози або чутливість до інсуліну. Вважається, що насправді найвища доза хрому має фармакологічні та нехарчові ефекти, щоб вказати його як важливий елемент.
історія хрому
Назва хром походить від грец кольоровість, що означає колір. Давши також назву цьому елементу, відбулося його відкриттяФранцузький фармацевт і хімік Луї Ніколя Воклен, в 1797 році, коли він помітив хром під час вивчення крокоїтової руди, PbCrO4. Однак спочатку метал не мав великого комерційного успіху.
Наприклад, через п’ятнадцять років після його відкриття сер Хамфрі Дейві не знав багато про хром і його сполуки, коли написав свою знамениту книгу. Елементи хімічної філософії, що свідчить лише про те, що хромова кислота мала кислий смак.
У тому ж році Йонс Якоб Берцеліус писав, що післясмак токсичної хромової кислоти був неприємним і металевим. Берцеліус зрозумів, що метал, хоча й крихкий, досить стійкий до дії кислоти і атмосферне повітря.
Хоча спочатку не мав великого комерційного успіху, наприкінці 19 на початку 20 ст., елемент почали використовуватися в комерційних цілях, оскільки стала широко використовуватися нержавіюча сталь, а також хромування деталей в автомобільній промисловості, завдяки чому хром став металом, що користується великим попитом.
Хром розв’язує вправи
питання 1
(UEFS/BA)Атом хрому має ступінь окиснення +3 у виді
А) Кр2THE3
Б) CrO
В) Кр
D) CrO42-
E) Кр2THE72-
Роздільна здатність:
Альтернатива А
У літері С хром виступає як проста речовина, тож, у цьому випадку, NOx дорівнює нулю.
THE кисень в інших сполуках це відбувається з NOx, рівним -2. Таким чином, ми можемо обчислити NOx хрому в усіх видах, зробивши його невідомим (x):
кр2THE3 → 2x + 3(-2) = 0 ⸫ x = +3
CrO → x + (-2) = 0 ⸫ x = +2
CrO42- → x + 4(-2) = -2 ⸫ x = +6
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
питання 2
(UPE 2013) Міжнародна група вчених виявила складну хімічну реакцію, що спричиняє погіршення деяких з них великі твори мистецтва в історії, створені Вінсентом Ван Гогом (1853–1890) та іншими відомими художниками 20 ст. XIX. У своїх дослідженнях ці дослідники штучно зістарили пігменти і виявили, що потемніння верхнього шару пов’язане зі зміною вмісту хрому в фарбі з Cr(VI) на Cr(III).
Доступний у: http://agencia.fapesp.br/13455 (адаптовано)
Дані:Cr (Z = 24), електронна конфігурація: [Ar] 4s1 3d5
З огляду на описану вище ситуацію, це так ПРАВИЛЬНОстверджувати, що (те)
А) окислення Cr(VI) до Cr(III) зіпсувало великі художні твори в історії.
Б) старіння каркасів пов'язане з електронним збудженням CuThe для Кр3+.
В) Процес відновлення Cr6+ для Кр3+ затьмарив відомі твори 19 ст.
Г) перетворення, що відбулося, окисило CuThe, відповідальний за блиск оригінальної картини.
E) перехід від Cr(VI) до Cr(III) – це хімічна реакція, яка відбувається лише через багато років.
Роздільна здатність:
Альтернатива C
Перехід від Cr(VI) до Cr(III) є процесом скорочення (зменшення NOx), що було відповідальним за затемнення екранів.
Стефано Араухо Новаїс
Вчитель хімії