О цирконій, символ Zr, атомний номер 40, є хімічним елементом, що належить до 5 групи Періодична таблиця. Він відрізняється високою стійкістю до корозії, а також хорошою термостабільністю.
елемент є хімічно дуже схожий на гафній, і через це кожен природний зразок цирконію має невеликий вміст гафнію. Його багато в земній корі, його вміст набагато вище, ніж у широко використовуваних елементів, таких як мідь, цинк і свинець.
Цирконій має широке застосування в атомній промисловості, оскільки низьке поглинання нейтронів робить його чудовим покриттям для палива, багатого діоксидом урану. Крім того, оскільки він вважається нетоксичним і дуже біосумісним, цирконій використовується в хірургічних протезах та імплантатах.
Читайте також: Уран — елемент великого значення для виробництва енергії
Резюме про цирконій
Цирконій - це а метал що належать до 5 групи періодичної системи.
Він завжди з’являється в природі з невеликим вмістом гафнію, оскільки ці елементи за хімічним складом дуже схожі.
Основними цирконіевими рудами є цирконіт і бадделєїт.
Поділ цирконію та гафнію дуже складний.
Цирконій має хорошу стійкість до корозії та високих температур.
Його можна використовувати в зубних імплантатах та інших протезах, оскільки він нетоксичний і має високу біосумісність.
Значна частина цирконію використовується в атомній промисловості.
Елемент був відкритий у 1789 році німецьким ученим Мартіном Клапротом.
Властивості цирконію
символ: Zr.
атомний номер: 40.
атомна маса: 91,224 м.куб.
електронегативність: 1,33.
Точка злиття: 1855°C.
Точка кипіння: 4409°C.
Щільність: 6,52 г см-3 (при 20°C).
електронна конфігурація: [Кр] 5 с2 4d2.
Серія «Хімія».: група 4, перехідні метали.
Особливості цирконію
Цирконій у своїй металевій формі є а сіруватий метал і який має хорошу корозійну стійкість, головним чином через шар ZrO2 що утворюється навколо нього, захищаючи внутрішню металеву масу. Однак при тонкому подрібненні цирконій дуже пірофорний, тобто він може самозайматися при контакті з повітрям, особливо при високих температурах.
За хімічним складом цирконій дуже близький до гафнію, не в останню чергу тому, що елементи зустрічаються в природі разом. Тому, як і гафній, цирконій не зазнає хімічних атак кислоти розведений (крім ВЧ), якщо вони не нагріваються. Лужні розчини не дуже ефективні щодо цирконію навіть при більш високих температурах.
У високотемпературних системах цирконій має здатність реагувати з більшістю неметали. При взаємодії видно, що найбільш стабільними є сполуки цирконію зі ступенем окислення +4, як і у випадку ZrO2 або ZrCl4. Нижчі ступені окислення, такі як +3, менш стабільні, на відміну від титан, найлегший елемент у групі 4, який має хорошу стійкість при цьому навантаженні.
Де можна знайти цирконій?

Серед елементів d-блоку періодичної таблиці цирконій є четвертим за поширеністю, після залізо, титан і марганцю. Вони існують більше 30 руди, які я маюім цирконію в його складі. Серед найбільш відомих і найважливіших є цирконіт (також відомий як циркон), ZrSiO4 і бадделєїт (або бадделєїт), ZrO2. Бадделейт навіть зустрічається в Бразилії.
Країни з найбільшими запасами цирконію — Австралія, Південна Африка та Мозамбік. Однак найбільшими виробниками є Китай, Франція, Індія, Росія, Німеччина та США.
Цікаво, що цирконій У деяких зустрічається у великій кількості зірки. Елемент був навіть ідентифікований у сонце і в метеоритах. Місячні зразки, отримані під час місій Apollo, підтвердили високий вміст ZrO2 в цих породах порівняно з наземними.
Дивіться також: Золото — благородний метал, який відрізняється хорошою електропровідністю
Отримання цирконію
цирконій природним чином зустрічається з гафнієм, завжди з вмістом другого елемента, який коливається від 1 до 3% мас. Незважаючи на їх низький вміст, розділити їх дуже важко.
Зазвичай для вилучення цирконію використовується процес Кролла. У цьому процесі ZrO2 Міститься в рудах при високій температурі перетворюється в ZrCl4. Таким способом можна отримати цирконій, використовуючи магній як відновник. Наступні реакції демонструють процес.
ZrO2 → ZrCl4 (за допомогою CCl4 при температурі 770 К)
ZrCl4 → Zr (з використанням Mg в атмосфері Ar при температурі 1420 K)
Однак велика хімічна подібність між Zr і Hf означає, що гафній залишається в кінцевій системі як стійка домішка. Таким чином, необхідно використання металургійної техніки для поділу Zr і Hf. Промисловість вже розвиває гідрометалургійний (тобто, що зустрічається у водному розчині) і пірометалургійний (без присутності води) шляхи.
Гідрометалургійним методом є фракційна кристалізація солей К2ZrF6 і К2HfF6, які не мають однакової розчинності у воді. Іншим методом розчинення є екстракція розчинником, за допомогою якої сполуки Zr і Hf розчиняються. у воді, а потім селективно екстрагують органічними розчинниками, такими як метилізобутилкетон і данина. Враховуючи складність поділу, комерційний цирконій зазвичай продається з вмістом Hf від 1 до 3% за масою.
цирконієві аплікації
Металевий цирконій є зайнятий у ліги, переважно в сталі, щоб зробити їх кращими з точки зору механічної та корозійної стійкості. Стабільність металу при високих температурах також дозволяє йому бути використовується в космічних кораблях, які зазнають великої шкоди через екстремальні умови, що виникають під час повторного входження в атмосферу Землі.
Оскільки цирконій визнаний нетоксичним і дуже стійким до корозії елементом, крім хорошої біосумісності, його також досліджується використання в хірургічних додатках, як у зубних протезах та імплантатах.
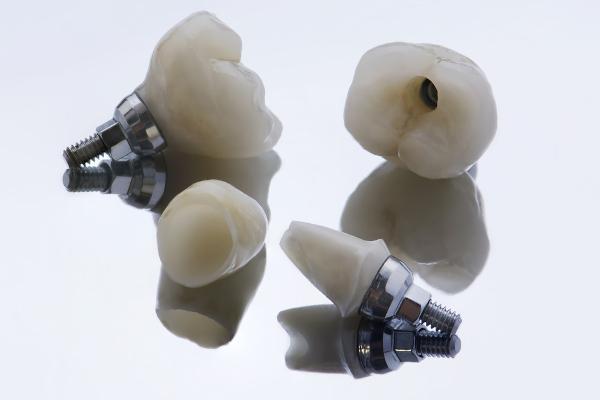
Діоксид цирконію, ZrO2, має дуже високу температуру плавлення, в межах 2500 °C. Таким чином, він використовується в виготовлення тари з високою термостійкістю, на додаток до високостійкої кераміки. З цієї причини цю кераміку навіть використовували в різальних машинах. ZrO2 Його також можна використовувати в косметиці, антиперспірантах, упаковці харчових продуктів і навіть підроблених дорогоцінних каменях.
Варто відзначити, що значна частина цирконію використовується атомна промисловість. Є, наприклад, Z-лігаircaloy®, металевий сплав цирконію та олова, розроблений виключно для ядерних цілей.
У атомній промисловості цирконій є використовується в упаковці, що міститьêм оксиду урану, паливо з електростанції. Тому що він дуже стійкий до води і з низьким уловом нейтронів, для цього виявляється непоганим матеріалом. Варто пам'ятати, що під час використовуються нейтрони поділ, і тому важливо, щоб цирконій не захоплював їх. Незахоплення також призводить до того, що цирконій не проявляється радіоактивність. Ось чому в цьому випадку цирконій не може мати слідів гафнію, металу, який має велику здатність захоплювати нейтрони.
Перевірте це на нашому подкасті:Як працюють атомні електростанції?
історія цирконію
Назва цирконій, ймовірно, походить від саргон, слово з сирійської мови, яке використовується для опису кольорів дорогоцінних каменів, які зараз відомі як цирконій. Хоча мінерали вже були відомі, не було відомо, що вони містять новий елемент до тих пір Мартін Хайрінх Клапрот у 1789 році зумів виявити елемент у Берліні. Німецький учений вирішив назвати елемент циркхорн.
1789 рік був дуже важливим для Клапрота, оскільки в цьому ж році вчений відкрив елемент уран.
Вирішені вправи з цирконію
питання 1
(ФГВ СП/2014 – адапт) Новий і перспективний клас надпровідних матеріалів заснований на складі ванадій-цирконій дибориду. Ця сполука синтезується із солі цирконію (IV).
(Журнал Пошук Фapesp, червень 2013 року. адаптований)
Кількість протонів і електронів в іоні Zr4+ дорівнює відповідно:
А) 36; 40
Б) 40; 40
В) 40; 44
Г) 40; 36
Д) 36; 36
Відповісти
Лист Д
Як і цирконій атомний номер дорівнює 40, можна зробити висновок, що його кількість протони також дорівнює 40, оскільки атомний номер чисельно дорівнює кількості протонів.
Представляючи заряд, рівний +4, ми знаємо, що цирконій в такому вигляді має чотири електрони якщо тільки в нейтральній формі.
У нейтральному стані кількість протонів дорівнює кількості електронів, тобто спочатку цирконій має 40 протонів і 40 електронів. Втративши чотири електрони, у цирконію залишилося лише 36.
питання 2
(Uerj 2013 —адаптований) Діоксид цирконію нагадує алмаз, алотропну форму вуглецю, який можна замінити на недорогі ювелірні вироби.
Позначте альтернативу, яка містить хімічну формулу діоксиду цирконію, а також тип міжатомного зв’язку цієї речовини.
А) ZrO4, ковалентний.
Б) ZrO2, іонний.
в) ZrO2, ковалентний.
D) ZrO4, іонний.
E) ZrO2, металевий.
Відповісти
Літера В
Діоксид цирконію, як випливає з його назви, повинен містити лише два атоми кисень. Таким чином, очікувана формула – ZrO2. Крім того, цирконій зазвичай набуває ступеня окислення, рівну +4.
Тип міжатомного зв’язку – це іонний, з двох причин:
цирконій — метал, а кисень — неметал;
різниця електронегативність між обома більше 1,7 (3,5 – 1,3 = 2,2).
Стефано Араухо Новаїс
Вчитель хімії
